Что такое угарный газ? Его свойства и формула. Чем опасен угарный газ для человека?
Дата публикации

Угарный газ — оксид углерода, о котором слишком часто приходится слышать, если речь идет об отравлении продуктами горения, несчастных случаях в промышленности или даже в быту. В силу особых ядовитых свойств этого соединения обычная домашняя газовая колонка может стать причиной гибели целой семьи. Примеров тому — сотни. Но почему так происходит? Что такое угарный газ на самом деле? Чем он опасен для человека?
Что такое угарный газ, формула, основные свойства
Угарный газ, формула которого очень проста и обозначает союз атома кислорода и углерода — CO, — одно из наиболее ядовитых газообразных соединений. Но в отличие от многих других опасных веществ, которые используются только для решения узких промышленных задач, химическое загрязнение монооксидом углерода может возникнуть в ходе совершенно обычных химических процессов, возможных даже в быту.
Впрочем, прежде чем перейти к тому, как происходит синтез этого вещества, рассмотрим, что такое угарный газ в целом и каковы его основные физические свойства:
- бесцветный газ без вкуса и запаха;
- крайне низкие температуры плавления и кипения: -205 и -191,5 градусов по Цельсию соответственно;
- плотность 0,00125 г/куб.см.;
- весьма горюч с высокой температурой горения (до 2100 градусов по Цельсию).
Образование угарного газа
В быту или промышленности образование угарного газа обычно происходит одним из нескольких достаточно простых способов, что легко объясняет риск случайного синтеза этого вещества с риском для персонала предприятия или жителей дома, где возникла неисправность отопительного оборудования или нарушена техника безопасности. Рассмотрим основные пути образования монооксида углерода:
- горение углерода (угля, кокса) или его соединений (бензина и другого жидкого топлива) в условиях нехватки кислорода. Как нетрудно догадаться, дефицит свежего воздуха, опасный с точки зрения риска синтеза угарного газа, легко возникает в двигателях внутреннего сгорания, бытовых колонках с нарушенной вентиляцией, промышленных и обычных печах;
- взаимодействие обычного углекислого газа с раскаленным углем. Такие процессы происходят в печи постоянно и полностью обратимы, но, при условии уже упомянутой нехватки кислорода, при закрытой заслонке, угарный газ образуется в значительно больших количествах, что представляет смертельную опасность для людей.
Чем опасен угарный газ?
В достаточной концентрации угарный газ, свойства которого объясняют его высокую химическую активность, чрезвычайно опасен для человеческой жизни и здоровья. Суть такого отравления заключается, прежде всего, в том, что молекулы этого соединения моментально связывают гемоглобин крови и лишают его способности переносить кислород. Таким образом, монооксид углерода снижает уровень клеточного дыхания с самыми серьезными последствиями для организма.
Отвечая на вопрос «Чем опасен угарный газ?» стоит упомянуть и то, что, в отличие от многих других токсичных веществ, человек не чувствует никакого специфического запаха, не испытывает неприятных ощущений и не способен распознать его наличие в воздухе любыми другими способами, не имея специального оборудования. В результате пострадавший просто не принимает никаких мер для того, чтобы спастись, а когда действие угарного газа (сонливость и потеря сознания) становится очевидным, может быть уже слишком поздно.
Угарный газ приводит к смерти в течение часа при концентрации в воздухе свыше 0,1%. При этом в выхлопе совершенно обычного легкового автомобиля содержится от 1,5 до 3% этого вещества. И это еще при условии хорошего состояния мотора. Это легко объясняет тот факт, что отравление угарным газом часто возникает именно в гаражах или внутри машины, загерметизированной снегом.
Другие наиболее опасные случаи, в которых люди отравились угарным газом в быту или на работе — это…
- перекрытие или поломка вентиляции отопительной колонки;
- неграмотное использования дровяных или угольных печей;
- на пожарах в закрытых помещениях;
- вблизи оживленных автомобильных магистралей;
- на промышленных предприятиях, где активно используется монооксид углерода.
Опубликовано в Выживание при химическом загрязнении
Добавить комментарий
Диоксид углерода — Википедия
| Диоксид углерода | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Диоксид углерода | ||
| Традиционные названия | углекислый газ, углекислота, двуокись углерода, сухой лёд (в твёрдом состоянии) | ||
| Хим. формула | CO2 | ||
| Рац. формула | CO2 | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 44,01 г/моль | ||
| Плотность | газ (0 °C): 1,9768 кг/м³ жидкость (0 °С, 35,5 ат): 925 кг/м³ тв. (−78,5 °C): 1560 кг/м³ | ||
| Динамическая вязкость | 8,5⋅10−5 Па·с (10°C, 5,7 МПа) | ||
| Энергия ионизации | 13,77 ± 0,01 эВ[2] | ||
| Скорость звука в веществе | 269 м/с | ||
| Температура | |||
| • сублимации | −78,5 °C | ||
| Тройная точка | −56,6 °C, 0,52 МПа [1] | ||
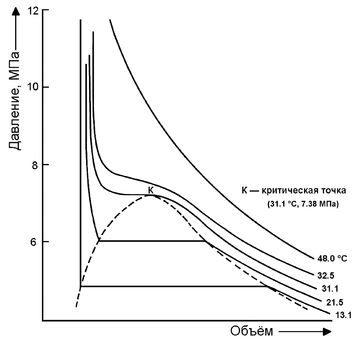
| Критическая точка | 31 °C, 7,38 МПа | ||
| Критическая плотность | 467 кг/м³ см³/моль | ||
| Уд. теплоёмк. | 849 Дж/(кг·К) | ||
| Теплопроводность | 0,0166 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | 394 кДж/моль | ||
| • плавления | 9,02 кДж/моль | ||
| • кипения | 16,7 кДж/моль | ||
| • сублимации | 26 кДж/моль | ||
| Удельная теплота испарения | 379,5 кДж/кг | ||
| Удельная теплота плавления | 205 кДж/кг | ||
| Давление пара | 56,5 ± 0,1 атм[2] | ||
| Растворимость | |||
| • в воде | 1,48 кг/м³ | ||
| Рег. номер CAS | 124-38-9 | ||
| PubChem | 280 | ||
| Рег. номер EINECS | 204-696-9 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E290 | ||
| RTECS | FF6400000 | ||
| ChEBI | 16526 | ||
| Номер ООН | 1013 | ||
| ChemSpider | 274 | ||
| Предельная концентрация | 9 000 мг/м3 | ||
| ЛД50 | LC50: 90 000 мг/м3*5 мин (человек, ингаляция) | ||
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | ||
| Фразы безопасности (S) | S9, S23, S36 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 | |||
Диокси́д углеро́да или двуо́кись углеро́да (также углеки́слый газ, углекислотá, окси́д углеро́да(IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), почти без запаха (в больших концентрациях с кисловатым «содовым» запахом), с химической формулой CO2.
Плотность при нормальных условиях 1,98 кг/м³ (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[3]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего должен участвовать в процессе глобального потепления [уточнить]. Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи[источник не указан 150 дней]. Рост содержания углекислого газа выше, до определённой концентрации, приводит к появлению облаков из углекислоты, что ведет к похолоданию.[4] Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.
Физические[править | править код]
Оксид углерода (IV) (углекислый газ) — бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В спокойном электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические[править | править код]
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щёлочами с образованием её солей — карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[5]:
- 2Mg+CO2⟶2MgO+C{\displaystyle {\ce {2Mg + CO2 -> 2MgO + C}}}.
Взаимодействие с оксидом активного металла:
- CaO+CO2⟶CaCO3{\displaystyle {\ce {CaO + CO2 -> CaCO3}}}.
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
- CO2+h3O⇄h3CO3{\displaystyle {\ce {CO2^{+}h3O\rightleftarrows h3CO3}}}.
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
- Ca(OH)2+CO2⟶CaCO3↓+h3O{\displaystyle {\ce {Ca(OH)2 + CO2 -> CaCO3 v + h3O}}} (качественная реакция на углекислый газ),
- KOH+CO2⟶KHCO3{\displaystyle {\ce {KOH + CO2 -> KHCO3}}}.
Биологические[править | править код]
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.[6]
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[7].
Содержание углекислого газа в крови человека приблизительно таково:
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2) Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[8]—6,8[8] 4,8 4,7[8]—6,0[8] мм рт. ст. 41—51 36 35[9]—45[9]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[10] при помощи реакции CO2+h3O⟶h3CO3⟶H++HCO3−{\displaystyle {\ce {CO2 + h3O -> h3CO3 -> H^+ + HCO3^-}}}.
- Около 5—10 % углекислого газа растворено в плазме крови[10].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[10].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[10].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 845 дней]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[11] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать CO2{\displaystyle {\ce {CO2}}}, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[11].
- CaCO3+2HCl⟶CaCl2+h3O+CO2↑{\displaystyle {\ce {CaCO3 + 2HCl -> CaCl2 + h3O + CO2 ^}}}.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется зкзотермическая реакция горения углерода в кислороде[11]:
- C+O2⟶CO2↑+394kJ{\displaystyle {\ce {C + O2 -> CO2 ^ + 394 kJ}}}.
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[12].
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO₂ в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO₂ (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[13].
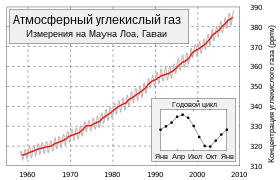
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[14].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Углекислый газ нетоксичен, но при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. По ГОСТу (ГОСТ 8050-85) углекислота относится к IV классу опасности.
Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. Опасными для здоровья концентрациями считаются концентрации около 7−10 %, при которых развиваются симптомы удушья, проявляющиеся в виде головной боли, головокружения, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), эти симптомы развиваются, в зависимости от концентрации, в течение времени от нескольких минут до одного часа.
Для помещений нормальным является уровень CO₂ около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга. [15]. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[16], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[17].
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | 600—1000 |
| Максимальный уровень стандартов ASHRAE и OSHA[18] | 1000 |
| Общая вялость | 1000—2500 |
| Возможны нежелательные эффекты на здоровье | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
При вдыхании воздуха с очень высокими концентрациями газа смерть наступает очень быстро от удушья, вызванного гипоксией[19].
Несмотря на то, что даже концентрация 5—7 % CO₂ в воздухе несмертельна, но при концентрации 0,1 % (такое содержание углекислого газа иногда наблюдается в воздухе мегаполисов), люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоком уровне кислорода, большая концентрация CO₂ существенно влияет на самочувствие человека.
| Симптомы у взрослых здоровых людей[20] | Концентрация углекислого газа, ppm |
|---|---|
| Легкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и легкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — смерть | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[21].
- ↑ Carbon Dioxide — Thermophysical Properties
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0103.html
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения 24 сентября 2013.
- ↑ Chen Zhou, Mark D. Zelinka & Stephen A. Klein. Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения 4 декабря 2019.
- ↑ А. С. Егоров. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ 7. How much carbon dioxide do humans contribute through breathing?. Frequent Questions — Emissions (англ.). US EPA. Дата обращения 4 декабря 2019. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry (неопр.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide (неопр.). solarnavigator.net. Дата обращения 12 октября 2007.
- ↑ 1 2 3 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: «Himiâ», 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок (рус.). Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения 4 декабря 2019.
- ↑ Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ Greenwood, Veronique. Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2019. — 6 May.
- ↑ Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2019.
- ↑ Сорокин, Андрей. «Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- ↑ Indoor Air Quality in Commercial and Institutional Buildings
- ↑ (англ.) Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency:.
- ↑ Приемлемые и опасные уровни концентрации углекислого газа (CO2) согласно ASHRAE и OSHA — США. Рекомендованные уровни вентиляции помещений.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (неопр.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Т. SAM—TR—67—77.
Оксиды углерода — урок. Химия, 8–9 класс.
Оксид углерода(\(II\)), или угарный газ
Оксид углерода(\(II\)) CO образуется при неполном сгорании топлива. Это бесцветный газ без запаха. Он плохо растворяется в воде (\(2,3\) см³ в \(100\) см³ при \(20\) °С). Оксид углерода(\(II\)) очень ядовит. При вдыхании его молекулы связываются с гемоглобином крови и препятствуют переносу кислорода.
Оксид углерода(\(II\)) относится к несолеобразующим оксидам. При обычных условиях он не реагирует с водой, кислотами и основаниями.
Является сильным восстановителем. Восстановительные свойства проявляет в реакциях с оксидами металлов и кислородом. Оксид углерода(\(II\)) отнимает кислород от оксидов металлов. В результате реакции образуются металл и углекислый газ:
Cu+2O+C+2O=tCu0+C+4O2.
Оксид углерода(\(II\)) горит на воздухе голубым пламенем:
2C+2O+O02=t2C+4O−22.
В реакции выделяется большое количество тепла.
Оксид углерода(\(IV\)), или углекислый газ
Оксид углерода(\(IV\)) CO2 — бесцветный газ без запаха. Он примерно в \(1,5\) раза тяжелее воздуха. Малорастворим в воде (при комнатной температуре в \(1\) объёме воды растворяется \(0,88\) объёма CO2). При охлаждении и повышенном давлении углекислый газ превращается в твёрдое вещество — «сухой лёд», который способен возгоняться, т. е. из твёрдого состояния переходить сразу в газообразное.

Сухой лёд
Оксид углерода(\(IV\)) — типичный кислотный оксид. Он взаимодействует с водой, основными оксидами и щелочами. В реакции с водой образуется неустойчивая угольная кислота:
CO2+h3O⇄h3CO3.
В реакциях с основными оксидами и щелочами образуются карбонаты:
CO2+CaO=CaCO3,
CO2+2NaOH=Na2CO3+h3O.
При взаимодействии щёлочи с избытком углекислого газа образуются гидрокарбонаты:
CO2+NaOH=NaHCO3.
В углекислом газе степень окисления углерода максимальная, поэтому он может проявлять окислительные свойства. Так, магний горит в атмосфере углекислого газа:
C+4O2+2Mg0=t2Mg+2O+C0.
Получение:
- в лаборатории углекислый газ получают действием кислот на карбонаты:
CaCO3+2HCl=CaCl2+h3O+CO2↑.
- В промышленности для его получения используют обжиг известняка:
CaCO3=tCaO+CO2↑.
В природе углекислый газ образуется при дыхании и сгорании топлива, при гниении и тлении органических веществ, а поглощается растениями в процессе фотосинтеза.
Угарный газ используется:
- в качестве топлива;
- как восстановитель в производстве чугуна;
- для получения метанола.
Углекислый газ применяется:
- в производстве газированных напитков;
- для тушения пожаров;
- для охлаждения пищевых продуктов («сухой лёд»).
Угарный газ Википедия
| Монооксид углерода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Монооксид углерода | ||
| Хим. формула | CO | ||
| Рац. формула | CO | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 28,01 г/моль | ||
| Плотность | 0,001250°C; 0,814-195°C г/см³ | ||
| Энергия ионизации | 14,01 ± 0,01 эВ[2] | ||
| Температура | |||
| • плавления | −205 °C | ||
| • кипения | −191,5 °C | ||
| Пределы взрываемости | 12,5 ± 0,1 об.%[2] | ||
| Энтальпия | |||
| • образования | −110,52 кДж/моль | ||
| Давление пара | 35 ± 1 атм[2] | ||
| Растворимость | |||
| • в воде | 0,0026 г/100 мл | ||
| Рег. номер CAS | 630-08-0 | ||
| PubChem | 281 | ||
| Рег. номер EINECS | 211-128-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | FG3500000 | ||
| ChEBI | 17245 | ||
| Номер ООН | 1016 | ||
| ChemSpider | 275 | ||
| Токсичность | Высокотоксичен, СДЯВ | ||
| Пиктограммы ECB | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Моноокси́д углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO.
Строение молекулы
Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой » :C≡O: «.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2
Oσ2
zπ4
x, y σ2
C. Тройная связь образована σ-связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум π-связям. Электроны на несвязывающих σC-орбитали и σO-орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13 Å).
Молекула слабо поляризована, её электрический дипольный момент μ = 0,04⋅10−29 Кл·м. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен на атоме углерода C−←O+ (направление дипольного момента в молекуле противоположно предполагавшемуся ранее). Энергия ионизации 14,0 эВ, силовая константа связи k = 18,6.
Свойства
Оксид углерода(II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже.
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830 °C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции
- h3O+CO⇄CO2+h3{\displaystyle {\mathsf {H_{2}O+CO\rightleftarrows CO_{2}+H_{2}}}}
до 830 °C смещено вправо, выше 830 °C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Оксид углерода(II) горит пламенем синего цвета[3] (температура начала реакции 700 °C) на воздухе:
- 2CO+O2→2CO2{\displaystyle {\mathsf {2CO+O_{2}\rightarrow 2CO_{2}}}} (ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K).
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления. В смеси с воздухом взрывоопасен; нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму)[4].
Оксид углерода(II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
- CO+Cl2→hνCOCl2.{\displaystyle {\mathsf {CO+Cl_{2}{\xrightarrow {h\nu }}COCl_{2}}}.}
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида COF2, можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
- (FCO)2O2+2KI→2KF+I2+2CO2.{\displaystyle {\mathsf {(FCO)_{2}O_{2}+2KI\rightarrow 2KF+I_{2}+2CO_{2}.}}}
Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
- CO+S→COS{\displaystyle {\mathsf {CO+S\rightarrow COS}}} (ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K).
Получены также аналогичные селеноксид углерода COSe и теллуроксид углерода COTe.
Восстанавливает SO2:
- 2CO+SO2→2CO2+S.{\displaystyle {\mathsf {2CO+SO_{2}\rightarrow 2CO_{2}+S.}}}
C переходными металлами образует горючие и ядовитые соединения — карбонилы, такие как [Fe(CO)5], [Cr(CO)6], [Ni(CO)4], [Mn2(CO)10], [Co2(CO)9] и др. Некоторые из них летучие.
- nCO+Me→[Me(CO)n]{\displaystyle {\mathsf {nCO+Me\rightarrow [Me(CO)_{n}]}}}
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:
- CO+KOH→HCOOK.{\displaystyle {\mathsf {CO+KOH\rightarrow HCOOK.}}}
Интересна реакция оксида углерода(II) с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
- 2K+2CO→K2C2O2.{\displaystyle {\mathsf {2K+2CO\rightarrow K_{2}C_{2}O_{2}.}}}
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (диоксид тория ThO2) по уравнению:
- CO+Nh4→h3O+HCN.{\displaystyle {\mathsf {CO+NH_{3}\rightarrow H_{2}O+HCN.}}}
Важнейшим свойством оксида углерода(II) является его способность реагировать с водородом с образованием органических соединений (процесс синтеза Фишера — Тропша):
- xCO+yh3→{\displaystyle {\mathsf {xCO+yH_{2}\rightarrow }}} спирты + линейные алканы.
Этот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
Физиологическое действие
Токсичность
Угарный газ очень токсичен.
TLV (предельная пороговая концентрация, США): 25 ppm; 29 мг/м³ (как TWA — среднесменная концентрация, США) (ACGIH 1994—1995). MAC (максимальная допустимая концентрация, США): 30 ppm; 33 мг/м³; Беременность: B (вредный эффект вероятен даже на уровне MAK) (1993). ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³ (около 0,0017 %).
В выхлопе бензинового автомобиля допускается до 1,5-3 % (допустимая концентрация сильно различается в зависимости от страны/применяемых стандартов; а 3% — много даже для старого карбюраторного автомобиля без катализатора).
По классификации ООН оксид углерода(II) относится к классу опасности 2,3, вторичная опасность по классификации ООН: 2,1.
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть.[5] Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, учащённое сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, обморочное отношение к людям, кома[6][3].
Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом (оксигемоглобином)[6]. Таким образом, блокируются процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа[6].
Опыты на молодых крысах показали, что концентрация CO в воздухе 0,02 % замедляет их рост и снижает активность по сравнению с контрольной группой.
Помощь при отравлении оксидом углерода(II)
Соединение окиси углерода с гемоглобином обратимо. При отравлении рекомендуются следующие действия[6]:
- Пострадавшего следует вынести на свежий воздух. При отравлении лёгкой степени достаточно гипервентиляции лёгких кислородом.
- Искусственная вентиляция лёгких, О2-терапия, в том числе в барокамере.
- Ацизол, хромосмон внутривенно.
Мировой медицине неизвестны надежные антидоты для применения в случае отравления угарным газом[7].
Защита от оксида углерода(II)
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух. Обычный способ защиты — использование изолирующего дыхательного аппарата[3].
Эндогенный монооксид углерода
Эндогенный монооксид углерода вырабатывается в норме клетками организма человека и животных и выполняет функцию сигнальной молекулы. Он играет известную физиологическую роль в организме, в частности, является нейротрансмиттером и вызывает вазодилатацию[8]. Ввиду роли эндогенного угарного газа в организме, нарушения его метаболизма связывают с различными заболеваниями, такими, как нейродегенеративные заболевания, атеросклероз кровеносных сосудов, гипертоническая болезнь, сердечная недостаточность, различные воспалительные процессы[8].
Эндогенный угарный газ образуется в организме благодаря окисляющему действию фермента гемоксигеназы на гем, являющийся продуктом разрушения гемоглобина и миоглобина, а также других гемосодержащих белков. Этот процесс вызывает образование в крови человека небольшого количества карбоксигемоглобина, даже если человек не курит и дышит не атмосферным воздухом (всегда содержащим небольшие количества экзогенного угарного газа), а чистым кислородом или смесью азота с кислородом.
Вслед за появившимися в 1993 году первыми данными о том, что эндогенный угарный газ является нормальным нейротрансмиттером в организме человека[9][10], а также одним из трёх эндогенных газов, которые в норме модулируют течение воспалительных реакций в организме (два других — оксид азота (II) и сероводород), эндогенный угарный газ привлёк значительное внимание клиницистов и исследователей как важный биологический регулятор. Было показано, что во многих тканях все три вышеупомянутых газа являются противовоспалительными веществами, вазодилататорами, а также вызывают ангиогенез[11]. Однако не всё так просто и однозначно. Ангиогенез — не всегда полезный эффект, поскольку он, в частности, играет роль в росте злокачественных опухолей, а также является одной из причин повреждения сетчатки при макулярной дегенерации. В частности, важно отметить, что курение (основной источник угарного газа в крови, дающий в несколько раз большую концентрацию его, чем естественная продукция) повышает риск макулярной дегенерации сетчатки в 4-6 раз.
Существует теория о том, что в некоторых синапсах нервных клеток, где происходит долговременное запоминание информации, принимающая клетка в ответ на принятый сигнал вырабатывает эндогенный угарный газ, который передаёт сигнал обратно передающей клетке, чем сообщает ей о своей готовности и в дальнейшем принимать сигналы от неё и повышая активность клетки-передатчика сигнала. Некоторые из этих нервных клеток содержат гуанилатциклазу, фермент, который активируется при воздействии эндогенного угарного газа[10].
Исследования, посвящённые роли эндогенного угарного газа как противовоспалительного вещества и цитопротектора, проводились во множестве лабораторий по всему миру. Эти свойства эндогенного угарного газа делают воздействие на его метаболизм интересной терапевтической мишенью для лечения таких разных патологических состояний, как повреждение тканей, вызванное ишемией и последующей реперфузией (а это, например, инфаркт миокарда, ишемический инсульт), отторжение трансплантата, атеросклероз сосудов, тяжёлый сепсис, тяжёлая малярия, аутоиммунные заболевания. Проводились в том числе и клинические испытания на человеке, однако результаты их пока ещё не опубликованы[12].
Суммируя, то, что известно на 2015 год о роли эндогенного угарного газа в организме, можно изложить следующим образом[13]:
- Эндогенный угарный газ — одна из важных эндогенных сигнальных молекул;
- Эндогенный угарный газ модулирует функции ЦНС и сердечно-сосудистой системы;
- Эндогенный угарный газ ингибирует агрегацию тромбоцитов и их адгезию к стенкам сосудов;
- Влияние на обмен эндогенного угарного газа в будущем может быть одной из важных терапевтических стратегий при ряде заболеваний.
История открытия
Токсичность дыма, выделяющегося при горении угля, была описана ещё Аристотелем и Галеном.
Оксид углерода(II) был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем.
То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крюйкшенк. Токсичность газа была исследована в 1846 году французским медиком Клодом Бернаром в опытах на собаках[14].
Оксид углерода(II) вне атмосферы Земли впервые был обнаружен бельгийским учёным М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК-спектре Солнца. Оксид углерода(II) в межзвёздной среде был обнаружен в 1970 г.[15]
Получение
Промышленный способ
Влияние температуры на равновесие реакции: CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}}- 2C+O2→2CO{\displaystyle {\mathsf {2C+O_{2}\rightarrow 2CO}}} (тепловой эффект этой реакции 220 кДж),
- CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}} (ΔH = 172 кДж, ΔS = 176 Дж/К)
Эта реакция происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом оксид углерода(II) вследствие своей ядовитости вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ»[3].
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400 °C равновесие практически полностью сдвинуто влево, а при температуре выше 1000 °C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому оксид углерода(II) при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
Лабораторный способ
- HCOOH→h3SO4oth3O+CO.{\displaystyle {\mathsf {HCOOH{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}H_{2}O+CO.}}}
- Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
- HCOOH+ClSO3H→h3SO4+HCl+CO↑.{\displaystyle {\mathsf {HCOOH+ClSO_{3}H\rightarrow H_{2}SO_{4}+HCl+CO\uparrow .}}}
- h3C2O4→h3SO4otCO↑+CO2↑+h3O.{\displaystyle {\mathsf {H_{2}C_{2}O_{4}{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}CO\uparrow +CO_{2}\uparrow +H_{2}O.}}}
- K4[Fe(CN)6]+6h3SO4+6h3O→ot2K2SO4+FeSO4+3(Nh5)2SO4+6CO↑.{\displaystyle {\mathsf {K_{4}[Fe(CN)_{6}]+6H_{2}SO_{4}+6H_{2}O{\xrightarrow[{}]{^{o}t}}2K_{2}SO_{4}+FeSO_{4}+3(NH_{4})_{2}SO_{4}+6CO\uparrow .}}}
- Mg+ZnCO3→otMgO+ZnO+CO↑.{\displaystyle {\mathsf {Mg+ZnCO_{3}{\xrightarrow[{}]{^{o}t}}MgO+ZnO+CO\uparrow .}}}
Определение оксида углерода(II)
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
- PdCl2+CO+h3O→Pd↓+CO2+2HCl.{\displaystyle {\mathsf {PdCl_{2}+CO+H_{2}O\rightarrow Pd\downarrow +CO_{2}+2HCl.}}}
Эта реакция очень чувствительная. Стандартный раствор: 1 грамм хлорида палладия на литр воды.
Количественное определение оксида углерода(II) основано на иодометрической реакции:
- 5CO+I2O5→5CO2+I2.{\displaystyle {\mathsf {5CO+I_{2}O_{5}\rightarrow 5CO_{2}+I_{2}.}}}
Применение
- Оксид углерода(II) является промежуточным реагентом, используемым в реакциях с водородом в важнейших промышленных процессах для получения органических спиртов и неразветвлённых углеводородов.
- Оксид углерода(II) применяется для обработки мяса животных и рыбы, придаёт им ярко-красный цвет и вид свежести, не изменяя вкуса (технологии Clear smoke[en] и Tasteless smoke[en]). Допустимая концентрация CO равна 200 мг/кг мяса.
- Оксид углерода(II) является основным компонентом генераторного газа, использовавшегося в качестве топлива в газогенераторных автомобилях.
- Угарный газ от выхлопа двигателей применялся нацистами в годы Второй мировой войны для массового умерщвления людей путём отравления.
Оксид углерода(II) в атмосфере Земли
Содержание CO в атмосфере Земли по данным MOPITTРазличают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Оксид углерода(II) образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение оксида углерода(II) за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв оксид углерода(II) выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % оксида углерода(II). В коммунальной сфере не применяется в виду наличия значительно более дешёвого и энергоэффективного аналога — природного газа.
Поступление CO от природных и антропогенных источников примерно одинаково.
Оксид углерода(II) в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года. Основной канал потери CO — окисление гидроксилом до диоксида углерода.
Оксид углерода(II) в космическом пространстве
Оксид углерода(II) — вторая по распространённости (после H2) молекула в межзвёздной среде[15]. Этот газ играет важную роль в эволюции молекулярных газовых облаков, в которых происходит активное звездообразование. Как и другие молекулы, CO излучает ряд инфракрасных линий, возникающих при переходах между вращательными уровнями молекулы; эти уровни возбуждаются уже при температурах в несколько десятков кельвин. Концентрация CO в межзвёздной среде достаточно мала, чтобы (в отличие от гораздо более распространённой молекулы H2) излучение в молекулярных вращательных линиях не испытывало сильного самопоглощения в облаке. В результате энергия почти беспрепятственно уходит из облака, которое остывает и сжимается, запуская механизм звездообразования. В наиболее плотных облаках, где самопоглощение в линиях CO оказывается значительным, становится заметной потеря энергии в линиях редкого изотопного аналога 13CO (относительная изотопная распространённость 13C — около 1 %). В связи с его более сильным излучением, по сравнению с атомарным водородом, оксид углерода(II) используется для поиска подобных газовых скоплений. В феврале 2012 года астрономы с использованием европейского космического телескопа «Планк» составили наиболее полную карту его распределения по небесной сфере[16].
См. также
Примечания
- ↑ Carbon Monoxide | Cameo Chemicals | Noaa
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0105.html
- ↑ 1 2 3 4 Оксид углерода (неопр.) (недоступная ссылка). Российская энциклопедия по охране труда: В 3 тт. — 2-е изд., перераб. и доп. — М.: Изд-во НЦ ЭНАС,2007. Дата обращения 5 июня 2012. Архивировано 22 июня 2012 года.
- ↑ Баратов А. Н. Пожаровзрывоопасность веществ и материалов и средства их тушения: Справочное издание: в 2-х книгах. — М.: Химия, 1990. — Т. Книга 2. — С. 384.
- ↑ Рощин А.В., Томилин В.В., Штернберг Э.Я. Окись углерода // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1981. — Т. 17. Ниландера проба — Остеопатии. — 512 с. — 150 800 экз.
- ↑ 1 2 3 4 Справочник фельдшера, под ред. А. Н. Шабанова. — М.: «Медицина», 1984.
- ↑ Scientists hunt for carbon monoxide poisoning antidote (англ.), Associated Press (9 December 2016). Дата обращения 29 сентября 2018. «we don’t have antidotes for carbon monoxide poisoning, and it’s the most common poisoning».
- ↑ 1 2 Wu, L; Wang, R. Carbon Monoxide: Endogenous Production, Physiological Functions, and Pharmacological Applications (англ.) // Pharmacol Rev (англ.)русск. : journal. — 2005. — December (vol. 57, no. 4). — P. 585—630. — DOI:10.1124/pr.57.4.3. — PMID 16382109.
- ↑ Verma, A; Hirsch, D.; Glatt, C.; Ronnett, G.; Snyder, S. Carbon monoxide: A putative neural messenger (англ.) // Science. — 1993. — Vol. 259, no. 5093. — P. 381—384. — DOI:10.1126/science.7678352. — Bibcode: 1993Sci…259..381V. — PMID 7678352.
- ↑ 1 2 Kolata, Gina. Carbon Monoxide Gas Is Used by Brain Cells As a Neurotransmitter (26 января 1993). Дата обращения 2 мая 2010.
- ↑ Li, L; Hsu, A; Moore, P. K. Actions and interactions of nitric oxide, carbon monoxide and hydrogen sulphide in the cardiovascular system and in inflammation—a tale of three gases! (англ.) // Pharmacology & therapeutics : journal. — 2009. — Vol. 123, no. 3. — P. 386—400. — DOI:10.1016/j.pharmthera.2009.05.005. — PMID 19486912.
- ↑ Johnson, Carolyn Y.. Poison gas may carry a medical benefit (16 октября 2009). Дата обращения 16 октября 2009.
- ↑ Olas, Beata. Carbon monoxide is not always a poison gas for human organism: Physiological and pharmacological features of CO (англ.) // Chemico-Biological Interactions (англ.)русск. : journal. — 2014. — 25 April (vol. 222, no. 5 October 2014). — P. 37—43. — DOI:10.1016/j.cbi.2014.08.005.
- ↑ Rosemary H. Waring, Glyn B. Steventon, Steve C. Mitchell. Molecules of death (неопр.). — Imperial College Press, 2007. — С. 38. — ISBN 1-86094-814-6.
- ↑ 1 2 Combes, Françoise. Distribution of CO in the Milky Way (англ.) // Annual Review of Astronomy & Astrophysics (англ.)русск. : journal. — 1991. — Vol. 29. — P. 195. — DOI:10.1146/annurev.aa.29.090191.001211. — Bibcode: 1991ARA&A..29..195C.
- ↑ «Планк» составил карту угарного газа в Галактике (Лента.ру).
Литература
- Ахметов Н. С. Общая и неорганическая химия. 5-е изд., испр. — М.: Высш. шк.; 2003 ISBN 5-06-003363-5
- Некрасов Б. В. Основы общей химии. Т. I, изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. Стр. 495—497, 511—513
- Химия: Справ. из./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Перс. с нем. 2-е изд., стереотип. — М.:Химия, 2000 ISBN 5-7245-0360-3 (рус.)
- Баратов А. Н. Пожаровзрывоопасность веществ и материалов и средства их тушения: Справочное издание: в 2-х книгах; Книга 2. — М.: Химия, 1990 — 384с.
Ссылки
Оксид углерода (II) | CHEMEGE.RU
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
H2C2O4 → CO + CO2 + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O2 → CO2
CO2 + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН4 + Н2O → СО + 3Н2
Также возможна паровая конверсия угля:
C0 + H2+O → C+2O + H20
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН4+О2 → 2СО + 4Н2
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O2 → 2CO2
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl2 → COCl2
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н2 → СН3ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe2O3 → 2Fe + 3CO2
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na2O2 → Na2CO3
УГАРНЫЙ ГАЗ | Энциклопедия Кругосвет
ОКСИД УГЛЕРОДА (УГАРНЫЙ ГАЗ). Углерода(II) оксид (угарный газ) СО, несолеообразующий оксид углерода. Это означает, что не существует кислоты, соответствующей этому оксиду. Оксид углерода(II) – газ без цвета и запаха, сжижающийся при атмосферном давлении при температуре –191,5о С и затвердевающий при –205о С. Молекула СО по своему строению аналогична молекуле N2: обе содержит равное число электронов (такие молекулы называются изоэлектронными), атомы в них соединены тройной связью (две связи в молекуле СО образованы за счет 2р-электронов атомов углерода и кислорода, а третья – по донорно-акцепторному механизму с участием неподеленной электронной пары кислорода и свободной 2р-орбитали углерода). В результате физические свойства СО и N2 (температуры плавления и кипения, растворимость в воде и т.д.) очень близки.
Оксид углерода(II) образуется при сгорании углеродсодержащих соединений при недостаточном доступе кислорода, а также при соприкосновении раскаленного угля с продуктом полного сгорания – углекислым газом: С + СО2 → 2СО. В лаборатории СО получают дегидратацией муравьиной кислоты действием концентрированной серной кислоты на жидкую муравьиную кислоту при нагревании, либо пропусканием паров муравьиной кислоты над Р2О5: НСООН → СО + Н2О. Получают СО и разложением щавелевой кислоты: Н2С2О4 → СО + СО2 + Н2О. От других газов СО легко отделить пропусканием через раствор щелочи.
При обычных условиях СО, как и азот, химически довольно инертен. Лишь при повышенных температурах проявляется склонность СО к реакциям окисления, присоединения и восстановления. Так, при повышенных температурах он реагирует со щелочами: CO + NaOH → HCOONa, CO + Ca(OH)2 → CaCO3 + h3. Эти реакции используются для удаления СО из технических газов.
Оксид углерода(II) – высококалорийное топливо: горение сопровождается выделением значительного количества теплоты (283 кДж на 1 моль СО). Смеси СО с воздухом взрываются при его содержании от 12 до 74%; к счастью, на практике такие смеси встречаются исключительно редко. В промышленности для получения СО проводят газификацию твердого топлива. Например, продувание водяного пара через слой раскаленного до 1000o С угля приводит к образованию водяного газа: С + Н2О → СО + Н2, обладающего очень высокой теплотворной способностью. Однако сжигание – далеко не самое выгодное использование водяного газа. Из него, например, можно получить (в присутствии различных катализаторов под давлением) смесь твердых, жидких и газообразных углеводородов – ценное сырье для химической промышленности (Реакция Фишера – Тропша). Из той же смеси, обогатив ее водородом и применив нужные катализаторы, можно получить спирты, альдегиды, кислоты. Особое значение имеет синтез метанола: СО + 2Н2 → СН3ОН – важнейшего сырья для органического синтеза, поэтому эту реакцию проводят в промышленности в больших масштабах.
Реакции, в которых СО является восстановителем, можно продемонстрировать на примере восстановления железа из руды в ходе доменного процесса: Fe3O4 + 4CO → 3Fe + 4CO2. Восстановление оксидов металлов оксидом углерода(II) имеет большое значение в металлургических процессах.
Для молекул СО характерны реакции присоединения к переходным металлам и их соединениям с образованием комплексных соединений – карбонилов. Примерами могут служить жидкие или твердые карбонилы металлов Fe(CO)4, Fe(CO)5, Fe2(CO)9, Ni(CO)4, Cr(CO)6 и др. Это очень ядовитые вещества, при нагревании вновь распадающиеся на металл и СО. Так можно получить порошкообразные металлы высокой чистоты. Иногда на конфорке газовой плиты видны «подтеки» металла, это – следствие образования и распада карбонила железа. В настоящее время синтезированы тысячи разнообразных карбонилов металлов, содержащих, помимо СО, неорганические и органические лиганды, например, PtCl2(CO), K3[W(CO)6(OH)3], Cr(C6H5Cl)(CO)3.
Для СО характерна также реакция соединения с хлором, которая на свету идет уже при комнатной температуре с образованием исключительно ядовитого фосгена: CO + Cl2 → COCl2. Реакция эта цепная, она идет по радикальному механизму с участием атомов хлора и свободных радикалов COCl. Несмотря на ядовитость, фосген широко применяется для синтеза многих органических соединений.
Оксид углерода(II) – сильный яд, так как образует с металлсодержащими биологически активными молекулами прочные комплексы; при этом нарушается тканевое дыхание. Особенно страдают клетки центральной нервной системы. Связывание СО с атомами Fe(II) в гемоглобине крови препятствует образованию оксигемоглоблина, который и переносит кислород из легких к тканям. Уже при содержании в воздухе 0,1% СО этот газ вытесняет из оксигемоглобина половину кислорода. В присутствии СО может наступить смерть от удушья даже при наличии большого количества кислорода. Поэтому СО получил название угарного газа. У «угоревшего» человека в первую очередь страдают головной мозг и нервная система. Для спасения необходим прежде всего чистый воздух, не содержащий СО (а еще лучше – чистый кислород), при этом связанный с гемоглобином СО постепенно замещается молекулами О2 и удушье проходит. Предельно допустимая среднесуточная концентрация СО в атмосферном воздухе составляет 3 мг/м3 (около 3.10–5%), в воздухе рабочей зоны – 20 мг/м3.
Обычно в атмосфере содержание СО не превышает 10–5%. Этот газ попадает в воздух в составе вулканических и болотных газов, с выделениями планктона и других микроорганизмов. Так, из поверхностных слоев океана в атмосферу ежегодно выделяется 220 млн тонн СО. Высока концентрация СО в угольных шахтах. Много угарного газа образуется при лесных пожарах. Выплавка каждого миллиона тонн стали сопровождается образованием 300 – 400 т СО. В сумме техногенное выделение СО в воздух достигает 600 млн тонн в год, из них более половины приходится на автотранспорт. При неотрегулированном карбюраторе в выхлопных газах может содержаться до 12% СО! Поэтому в большинстве стран введены жесткие нормы на содержание СО в выхлопе автомобилей.
Образование СО всегда происходит при сгорании углеродсодержащих соединений, в том числе древесины, при недостаточном доступе кислорода, а также при соприкосновении раскаленного угля с углекислым газом: С + СО2 → 2СО. Такие процессы происходят и деревенских печах. Поэтому преждевременное закрывание дымохода печи для сохранения тепла часто приводит к отравлению угарным газом. Не следует думать что горожане, которые не топят печи, застрахованы от отравления СО; им, например, легко отравиться в плохо проветриваемом гараже, где стоит автомобиль с работающим мотором. Содержится СО и в продуктах сгорания природного газа на кухне. Многие авиационные катастрофы в прошлом произошли из-за износа двигателей или плохой их регулировки: в кабину пилотов проникал СО и отравлял экипаж. Опасность усугубляется тем, что СО невозможно обнаружить по запаху; в этом отношении угарный газ опаснее хлора!
Оксид углерода(II) практически не сорбируется активным углем и потому обычный противогаз не спасает от этого газа; для его поглощения необходим дополнительный гопкалитовый патрон, содержащий катализатор, который «дожигает» СО до СО2 с помощью кислорода воздуха. Катализаторами дожигания снабжается сейчас все больше легковых автомобилей, несмотря на высокую стоимость этих катализаторов на основе платиновых металлов.
Илья Леенсон
Проверь себя!
Ответь на вопросы викторины «Неизвестные подробности»
Какой музыкальный инструмент не может звучать в закрытом помещении?
Угарный газ — Википедия
Материал из Википедии — свободной энциклопедии
(перенаправлено с «»)
Перейти к навигации Перейти к поиску| Монооксид углерода | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | Монооксид углерода |
| Хим. формула | CO |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 28,01 г/моль |
| Плотность | 0,001250°C; 0,814-195°C г/см³ |
| Энергия ионизации | 14,01 ± 0,01 эВ[2] |
| Термические свойства | |
| Т. плав. | −205 °C |
| Т. кип. | −191,5 °C |
| Пр. взрв. | 12,5 ± 0,1 об.%[2] |
| Энтальпия образования | −110,52 кДж/моль |
| Давление пара | 35 ± 1 атм[2] |
| Химические свойства | |
| Растворимость в воде | 0,0026 г/100 мл |
| Классификация | |
| Рег. номер CAS | 630-08-0 |
| PubChem | 281 |
| Рег. номер EINECS | 211-128-3 |
| SMILES | |
| InChI | |
| 006-001-00-2 | |
| RTECS | FG3500000 |
| ChEBI | 17245 |
| Номер ООН | 1016 |
| ChemSpider | 275 |
| Безопасность | |
| Токсичность | Высокотоксичен, СДЯВ  |
| NFPA 704 |  |


 (
(
