Монооксид углерода — Википедия
| Монооксид углерода | |||
|---|---|---|---|
| |||
| Систематическое наименование | Монооксид углерода | ||
| Хим. формула | CO | ||
| Рац. формула | CO | ||
| Состояние | бесцветный газ | ||
| Молярная масса | 28,01 г/моль | ||
| Плотность | 0,001250°C; 0,814-195°C г/см³ | ||
| Энергия ионизации | 14,01 ± 0,01 эВ | ||
| Температура | |||
| • плавления | −205 °C | ||
| • кипения | −191,5 °C | ||
| Пределы взрываемости | 12,5 ± 0,1 об.%[2] | ||
| Энтальпия | |||
| • образования | −110,52 кДж/моль | ||
| Давление пара | 35 ± 1 атм[2] | ||
| Растворимость | |||
| • в воде | 0,0026 г/100 мл | ||
| Рег. номер CAS | 630-08-0 | ||
| PubChem | 281 | ||
| Рег. номер EINECS | 211-128-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | FG3500000 | ||
| ChEBI | 17245 | ||
| Номер ООН | 1016 | ||
| ChemSpider | 275 | ||
| Токсичность | Высокотоксичен, СДЯВ | ||
| Пиктограммы ECB |    | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Моноокси́д углеро́да (уга́рный газ, о́кись углеро́да, оксид углерода(II)) — бесцветный чрезвычайно токсичный газ без вкуса и запаха, легче воздуха (при нормальных условиях). Химическая формула — CO.
Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой » :C≡O: «.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2
Oσ2
zπ4
x, y σ2
C. Тройная связь образована σ-связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум π-связям. Электроны на несвязывающих σ C-орбитали и σO-орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13 Å).
Молекула слабо поляризована, её электрический дипольный момент μ = 0,04⋅10−29 Кл·м. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен на атоме углерода C−←O+ (направление дипольного момента в молекуле противоположно предполагавшемуся ранее). Энергия ионизации 14,0 эВ, силовая константа связи k = 18,6.
Оксид углерода(II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже.
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO 3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830 °C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции
- h3O+CO⇄CO2+h3{\displaystyle {\mathsf {H_{2}O+CO\rightleftarrows CO_{2}+H_{2}}}}
до 830 °C смещено вправо, выше 830 °C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Оксид углерода(II) горит пламенем синего цвета[3] (температура начала реакции 700 °C) на воздухе:
- 2CO+O2→2CO2{\displaystyle {\mathsf {2CO+O_{2}\rightarrow 2CO_{2}}}} (ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K).
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления. В смеси с воздухом взрывоопасен; нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму)[4].
Оксид углерода(II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
- CO+Cl2→hνCOCl2.{\displaystyle {\mathsf {CO+Cl_{2}{\xrightarrow {h\nu }}COCl_{2}}}.}
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F 2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида COF2, можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
- (FCO)2O2+2KI→2KF+I2+2CO2.{\displaystyle {\mathsf {(FCO)_{2}O_{2}+2KI\rightarrow 2KF+I_{2}+2CO_{2}.}}}
Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
Получены также аналогичные селеноксид углерода COSe и теллуроксид углерода COTe.
Восстанавливает SO2:
- 2CO+SO2→2CO2+S.{\displaystyle {\mathsf {2CO+SO_{2}\rightarrow 2CO_{2}+S.}}}
C переходными металлами образует горючие и ядовитые соединения — карбонилы, такие как [Fe(CO)5], [Cr(CO)6], [Ni(CO)4], [Mn2(CO)10], [Co2(CO)9] и др. Некоторые из них летучие.
- nCO+Me→[Me(CO)n]{\displaystyle {\mathsf {nCO+Me\rightarrow [Me(CO)_{n}]}}}
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:
-
- CO+KOH→HCOOK.{\displaystyle {\mathsf {CO+KOH\rightarrow HCOOK.}}}
Интересна реакция оксида углерода(II) с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
- 2K+2CO→K2C2O2.{\displaystyle {\mathsf {2K+2CO\rightarrow K_{2}C_{2}O_{2}.}}}
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (диоксид тория ThO2) по уравнению:
- CO+Nh4→h3O+HCN.{\displaystyle {\mathsf {CO+NH_{3}\rightarrow H_{2}O+HCN.}}}
Важнейшим свойством оксида углерода(II) является его способность реагировать с водородом с образованием органических соединений (процесс синтеза Фишера — Тропша):
- xCO+yh3→{\displaystyle {\mathsf {xCO+yH_{2}\rightarrow }}} спирты + линейные алканы.
Этот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
Токсичность[править | править код]
Угарный газ очень токсичен.
TLV (предельная пороговая концентрация, США): 25 ppm; 29 мг/м³ (как TWA — среднесменная концентрация, США) (ACGIH 1994—1995). MAC (максимальная допустимая концентрация, США): 30 ppm; 33 мг/м³; Беременность: B (вредный эффект вероятен даже на уровне MAK) (1993). ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³ (около 0,0017 %).
В выхлопе бензинового автомобиля допускается до 1,5-3 % (допустимая концентрация сильно различается в зависимости от страны/применяемых стандартов; а 3% — много даже для старого карбюраторного автомобиля без катализатора).
По классификации ООН оксид углерода(II) относится к классу опасности 2,3, вторичная опасность по классификации ООН: 2,1.
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть.[5] Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, учащённое сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, обморочное отношение к людям, кома[6][3].
Токсическое действие оксида углерода(II) обусловлено образованием карбоксигемоглобина — значительно более прочного карбонильного комплекса с гемоглобином, по сравнению с комплексом гемоглобина с кислородом (оксигемоглобином)[6]. Таким образом, блокируются процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа[6].
Опыты на молодых крысах показали, что концентрация CO в воздухе 0,02 % замедляет их рост и снижает активность по сравнению с контрольной группой.
Помощь при отравлении оксидом углерода(II)[править | править код]
Соединение окиси углерода с гемоглобином обратимо. При отравлении рекомендуются следующие действия[6]:
- Пострадавшего следует вынести на свежий воздух. При отравлении лёгкой степени достаточно гипервентиляции лёгких кислородом.
- Искусственная вентиляция лёгких, О2-терапия, в том числе в барокамере.
- Ацизол, хромосмон внутривенно.
Мировой медицине неизвестны надежные антидоты для применения в случае отравления угарным газом[7].
Защита от оксида углерода(II)[править | править код]
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух. Обычный способ защиты — использование изолирующего дыхательного аппарата[3].
Эндогенный монооксид углерода[править | править код]
Эндогенный монооксид углерода вырабатывается в норме клетками организма человека и животных и выполняет функцию сигнальной молекулы. Он играет известную физиологическую роль в организме, в частности, является нейротрансмиттером и вызывает вазодилатацию[8]. Ввиду роли эндогенного угарного газа в организме, нарушения его метаболизма связывают с различными заболеваниями, такими, как нейродегенеративные заболевания, атеросклероз кровеносных сосудов, гипертоническая болезнь, сердечная недостаточность, различные воспалительные процессы[8].
Эндогенный угарный газ образуется в организме благодаря окисляющему действию фермента гемоксигеназы на гем, являющийся продуктом разрушения гемоглобина и миоглобина, а также других гемосодержащих белков. Этот процесс вызывает образование в крови человека небольшого количества карбоксигемоглобина, даже если человек не курит и дышит не атмосферным воздухом (всегда содержащим небольшие количества экзогенного угарного газа), а чистым кислородом или смесью азота с кислородом.
Вслед за появившимися в 1993 году первыми данными о том, что эндогенный угарный газ является нормальным нейротрансмиттером в организме человека[9][10], а также одним из трёх эндогенных газов, которые в норме модулируют течение воспалительных реакций в организме (два других — оксид азота (II) и сероводород), эндогенный угарный газ привлёк значительное внимание клиницистов и исследователей как важный биологический регулятор. Было показано, что во многих тканях все три вышеупомянутых газа являются противовоспалительными веществами, вазодилататорами, а также вызывают ангиогенез[11]. Однако не всё так просто и однозначно. Ангиогенез — не всегда полезный эффект, поскольку он, в частности, играет роль в росте злокачественных опухолей, а также является одной из причин повреждения сетчатки при макулярной дегенерации. В частности, важно отметить, что курение (основной источник угарного газа в крови, дающий в несколько раз большую концентрацию его, чем естественная продукция) повышает риск макулярной дегенерации сетчатки в 4-6 раз.
Существует теория о том, что в некоторых синапсах нервных клеток, где происходит долговременное запоминание информации, принимающая клетка в ответ на принятый сигнал вырабатывает эндогенный угарный газ, который передаёт сигнал обратно передающей клетке, чем сообщает ей о своей готовности и в дальнейшем принимать сигналы от неё и повышая активность клетки-передатчика сигнала. Некоторые из этих нервных клеток содержат гуанилатциклазу, фермент, который активируется при воздействии эндогенного угарного газа[10].
Исследования, посвящённые роли эндогенного угарного газа как противовоспалительного вещества и цитопротектора, проводились во множестве лабораторий по всему миру. Эти свойства эндогенного угарного газа делают воздействие на его метаболизм интересной терапевтической мишенью для лечения таких разных патологических состояний, как повреждение тканей, вызванное ишемией и последующей реперфузией (а это, например, инфаркт миокарда, ишемический инсульт), отторжение трансплантата, атеросклероз сосудов, тяжёлый сепсис, тяжёлая малярия, аутоиммунные заболевания. Проводились в том числе и клинические испытания на человеке, однако результаты их пока ещё не опубликованы[12].
Суммируя, то, что известно на 2015 год о роли эндогенного угарного газа в организме, можно изложить следующим образом[13]:
- Эндогенный угарный газ — одна из важных эндогенных сигнальных молекул;
- Эндогенный угарный газ модулирует функции ЦНС и сердечно-сосудистой системы;
- Эндогенный угарный газ ингибирует агрегацию тромбоцитов и их адгезию к стенкам сосудов;
- Влияние на обмен эндогенного угарного газа в будущем может быть одной из важных терапевтических стратегий при ряде заболеваний.
Токсичность дыма, выделяющегося при горении угля, была описана ещё Аристотелем и Галеном.
Оксид углерода(II) был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем.
То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крюйкшенк. Токсичность газа была исследована в 1846 году французским медиком Клодом Бернаром в опытах на собаках[14].
Оксид углерода(II) вне атмосферы Земли впервые был обнаружен бельгийским учёным М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК-спектре Солнца. Оксид углерода(II) в межзвёздной среде был обнаружен в 1970 г.[15]
Промышленный способ[править | править код]
Влияние температуры на равновесие реакции: CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}}- 2C+O2→2CO{\displaystyle {\mathsf {2C+O_{2}\rightarrow 2CO}}} (тепловой эффект этой реакции 220 кДж),
- CO2+C⇄2CO{\displaystyle {\mathsf {CO_{2}+C\rightleftarrows 2CO}}} (ΔH = 172 кДж, ΔS = 176 Дж/К)
Эта реакция происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом оксид углерода(II) вследствие своей ядовитости вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ»[3].
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400 °C равновесие практически полностью сдвинуто влево, а при температуре выше 1000 °C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому оксид углерода(II) при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
Лабораторный способ[править | править код]
- HCOOH→h3SO4oth3O+CO.{\displaystyle {\mathsf {HCOOH{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}H_{2}O+CO.}}}
- Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
- HCOOH+ClSO3H→h3SO4+HCl+CO↑.{\displaystyle {\mathsf {HCOOH+ClSO_{3}H\rightarrow H_{2}SO_{4}+HCl+CO\uparrow .}}}
- h3C2O4→h3SO4otCO↑+CO2↑+h3O.{\displaystyle {\mathsf {H_{2}C_{2}O_{4}{\xrightarrow[{H_{2}SO_{4}}]{^{o}t}}CO\uparrow +CO_{2}\uparrow +H_{2}O.}}}
- K4[Fe(CN)6]+6h3SO4+6h3O→ot2K2SO4+FeSO4+3(Nh5)2SO4+6CO↑.{\displaystyle {\mathsf {K_{4}[Fe(CN)_{6}]+6H_{2}SO_{4}+6H_{2}O{\xrightarrow[{}]{^{o}t}}2K_{2}SO_{4}+FeSO_{4}+3(NH_{4})_{2}SO_{4}+6CO\uparrow .}}}
- Mg+ZnCO3→otMgO+ZnO+CO↑.{\displaystyle {\mathsf {Mg+ZnCO_{3}{\xrightarrow[{}]{^{o}t}}MgO+ZnO+CO\uparrow .}}}
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
- PdCl2+CO+h3O→Pd↓+CO2+2HCl.{\displaystyle {\mathsf {PdCl_{2}+CO+H_{2}O\rightarrow Pd\downarrow +CO_{2}+2HCl.}}}
Эта реакция очень чувствительная. Стандартный раствор: 1 грамм хлорида палладия на литр воды.
Количественное определение оксида углерода(II) основано на иодометрической реакции:
- 5CO+I2O5→5CO2+I2.{\displaystyle {\mathsf {5CO+I_{2}O_{5}\rightarrow 5CO_{2}+I_{2}.}}}
- Оксид углерода(II) является промежуточным реагентом, используемым в реакциях с водородом в важнейших промышленных процессах для получения органических спиртов и неразветвлённых углеводородов.
- Оксид углерода(II) применяется для обработки мяса животных и рыбы, придаёт им ярко-красный цвет и вид свежести, не изменяя вкуса (технологии Clear smoke[en] и Tasteless smoke[en]). Допустимая концентрация CO равна 200 мг/кг мяса.
- Оксид углерода(II) является основным компонентом генераторного газа, использовавшегося в качестве топлива в газогенераторных автомобилях.
- Угарный газ от выхлопа двигателей применялся нацистами в годы Второй мировой войны для массового умерщвления людей путём отравления.
 Содержание CO в атмосфере Земли по данным MOPITT
Содержание CO в атмосфере Земли по данным MOPITTРазличают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Оксид углерода(II) образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение оксида углерода(II) за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв оксид углерода(II) выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % оксида углерода(II). В коммунальной сфере не применяется в виду наличия значительно более дешёвого и энергоэффективного аналога — природного газа.
Поступление CO от природных и антропогенных источников примерно одинаково.
Оксид углерода(II) в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года. Основной канал потери CO — окисление гидроксилом до диоксида углерода.
Отравление угарным газом, симптомы, первая и неотложная помощь
Отравление угарным газом — одно из часто встречающихся отравлений в быту, оно очень опасно и нередко приводит к тяжелым последствиям и даже смертельному исходу.
Характеристика угарного газа
СО (угарный газ) — продукт неполного сгорания органических веществ. Это газ без цвета, вкуса и запаха, не раздражает кожу и слизистые оболочки, поэтому органолептически не определяется в воздухе. Источником этого яда может быть любое пламя, работающие двигатели внутреннего сгорания, не отрегулированное печное отопление, повреждение газопроводов в квартирах и других помещениях.
Чаще острое отравление угарным газом получают в гаражах, квартирах, на пожарах, авариях на производстве. В таких случаях концентрация СО может достичь значительных уровней. Так, в выхлопных газах автомобилей она может превышать 3-6%.
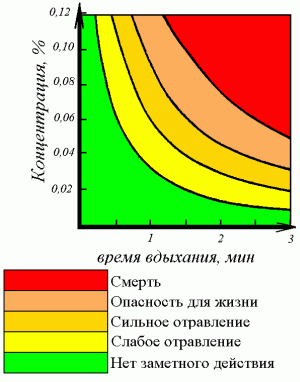
Угарный газ обладает высокой токсичностью, которая и определяется его концентрацией в воздухе. Так, при нахождении человека в помещении, где его концентрация достигает 0,1%, в течение 1 ч, у него развивается острое отравление средней тяжести; тяжелое — при концентрации 0,3% в течение 30 мин, а смертельное — когда человек вдыхает воздух с 0,4% СО в течение 30 мин или 0,5% всего 1 мин.
Образование карбоксигемоглобина
Опасность для людей и животных возникает при ингаляционном проникновении угарного газа в организм и определяется в значительной степени сродством СО с железосодержащими соединениями: гемоглобина, миоглобина, цитохромными ферментами, которые образуют обратные комплексы. В частности СО, взаимодействуя с гемоглобином, переводит его в состояние карбоксигемоглобина (сонь). Он способен переносить кислород от легких к тканям. Мало того, в присутствии сонь уменьшается диссоциация оксигемоглобина на О2 и гемоглобин. Это затрудняет транспортировку кислорода в ткани и негативно отражается на деятельности органов и систем организма, прежде всего головного мозга и сердца.
У лиц, которые дышат воздухом, содержащим 0,1% СО, уровень сонь в крови может достигнуть 50%. Такому высокому уровню этого соединения способствует значительный аффинитет (родство) СО с гемоглобином, который в 220 раз превышает сродство О2. Диссоциация карбоксигемоглобина в 3600 раз медленнее оксигемоглобина. Устойчивость его в организме создает основу для развития гемической и тканевой гипоксии.
Антагонистом угарного газа в организме является кислород. При давлении воздуха в 1 атм., T СО из организма составляет около 320 мин, при вдыхании 100% кислорода — 80 мин, а в барокамере (2-3 атм.) — уменьшается до 20 мин.
Признаки отравления угарным газом
Отравления окисью углерода очень опасны, так как выходящий угарный газ не имеет запаха и бесцветный. Человек даже не понимает, что подвергается смертельной опасности.
Признаками отравления угарным газом являются:
- сонливость,
- проблемы со зрением и слухом,
- головная боль,
- головокружение,
- одышка,
- шум в ушах,
- тошнота,
- равнодушие к опасности,
- потеря сознания,
- конвульсии.
Симптомы отравления
Проявления интоксикации угарным газом определяются не только содержанием его в воздухе, но и длительности действия и интенсивности дыхания. Вдыхание СО в концентрации 0,05% в течение 60 мин приводит к появлению легкой головной боли. При этом в крови концентрация сонь не превышает 20%. Более длительное воздействие или более интенсивное вдыхание могут способствовать увеличению содержания сонь до 40-50%. Клинически это проявляется значительной головной болью, спутанностью, ярко-красной окраской кожи и слизистых оболочек. При концентрации СО в воздухе 0,1% наступает потеря сознания, ослабляется дыхание. Возможна смерть, если продолжительность действия газа превышает 1 час. При этом уровень сонь может достичь 60-90%. На уровне сонь менее 15% признаки острого отравления отсутствуют.
Тяжесть острого отравления угарным газом возрастает при переутомлении, кровопотере, гиповитаминозах, при наличии у пострадавших сопутствующих заболеваний, особенно сердечно-сосудистой и респираторной систем, при высокой температуре воздуха, снижении содержания О2 и повышении СО2 в нем.
Ведущими клиническими признаками острого отравления угарным газом являются гипоксия и появление симптомов в такой последовательности:
- а) психомоторные нарушения;
- б) головная боль и чувство сдавления в височной области;
- в) спутанность сознания и понижение остроты зрения;
- г) тахикардия, тахипноэ, потеря сознания, кома;
- д) глубокая кома, судороги, шок и остановка дыхания.
Степени острой интоксикации
Различают 4 степени тяжести острого отравления угарным газом СО: легкая, средняя, тяжелая и молниеносная.
Легкое отравление
Легкое отравление СО наступает тогда, когда уровень сонь в плазме достигает 20-30%. Появляется головная боль, головокружение, чувство тяжести и сдавливания в голове, пульсация в висках, шум в ушах, сонливость и вялость. Возможна эйфория со зрительными и слуховыми галлюцинациями, тошнота, иногда рвота. Нередко развивается тахикардия, умеренная гипертензия, одышка. Умеренно расширенные зрачки реагируют на свет.
Отравление средней тяжести
Проявления острого отравления средней тяжести возникают, когда уровень сонь возрастает до 50%. Клинически это проявляется сонливостью, резким головокружением и головной болью, нарастающей слабостью, нарушением координации движений, рвотой. Характерная кратковременная потеря сознания и памяти, появление судорог, тонического сокращения жевательных мышц (тризм). Как и при легком отравлении, кожа и слизистые оболочки остаются ярко-красными, сердцебиение и одышка нарастают, иногда развивается коматозное состояние.
Тяжелое отравление
Когда содержание сонь в крови превышает 50% — состояние пострадавших резко ухудшается (тяжелая степень интоксикации). У больных сознание может не восстанавливаться. Возникают такие проявления поражения ЦНС, как галлюцинации, бред, клонико-тонические судороги, парезы и параличи, децеребральная ригидность, гипертермия, менингитные симптомы, а со стороны системы кровообращения — резкая тахикардия, аритмии, стенокардия, тахипноэ. Дыхание становится патологическим, типа Чейна-Стокса.
Мочеиспускание и дефекация непроизвольные.
В зависимости от обстоятельств клиническая картина острых интоксикаций может дополняться другими проявлениями. Так, на пожарах может развиться ожог верхних дыхательных путей, острая дыхательная недостаточность по аспирационно-обтурационному типу, внезапная смерть (молниеносная степень отравления). Пострадавшие моментально теряют сознание. У них останавливается дыхание, а через 3-5 мин и сердце.
Кроме того, острое отравление угарным газом в токсикогенной фазе может осложниться отеком мозга, отеком легких, инфарктом миокарда, а в соматогенной фазе — полиневритами, пневмонией, нарушением трофики кожи, острой недостаточностью почек.
На доврачебном этапе диагностика острой интоксикации СО базируется на результатах клинических проявлений, данных анамнеза, анализа обстоятельств на месте происшествия. В лабораторию на анализ передается 5 мл крови (с 1-2 каплями гепарина). Пациентов эвакуируют в стационар, желательно с барокамерой.
Что делать при отравлении угарным газом
Когда мы видим человека в бессознательном состоянии, в первую очередь нужно оценить, что с ним случилось. Для того, чтобы понять, следует изучить окружающую среду потерпевшего.
Если человек в бессознательном состоянии предположить, что он отравился угарным газом, можно если:
1. Пострадавший находится в гараже при работающем двигателе автомобиля.
2. Пострадавший находится у печи.
Человек отравившийся окисью углерода будет иметь трудности с дыханием, до тех пор, пока он находится в сознании.
Что делать?
Прежде всего, не паникуйте.
Перемещая пострадавшего нужно всегда помнить о собственной безопасности. Поэтому, старайтесь не дышать воздухом, выдыхаемым пострадавшим и воздухом в помещении, где есть утечка газа.
Первый шаг: свежий воздух
Если человек потерял сознание, его нужно вынести на свежий воздух . Если это невозможно, обеспечить свежий воздух на месте (выключить машину, открыть дверь гаража, окно).
Второй шаг: оценка дыхательной функции жертвы
В случае бессознательного состояния, после обеспечения свежего воздуха, ему нужно проводить искусственное дыхание. В случае аномалии, немедленно позвонить в скорую помощь, а затем приступить к массажу грудной клетки (30 сжатий и 2 вдоха).
Третий шаг: в ожидании помощи
Если удалось восстановить правильное дыхание, помещаем пострадавшего в безопасное положение и с нетерпением ожидаем прибытия медицинской помощи. Во время ожидания нельзя оставлять больного, нужно постоянно проверить его состояние. Кроме того, больного следует укрыть — защитить от переохлаждения.
Неотложная помощь при интоксикации
Неотложная помощь заключается в немедленном прекращении дальнейшего проникновения угарного газа в организм потерпевшего и обеспечении его спокойствием, теплом и высоким уровнем вентиляции. Для этого следует немедленно вынести его из загрязненного помещения, обеспечить доступ чистого воздуха или кислорода. Поднести к носу ватку, смоченную нашатырным спиртом, растереть грудь, на ноги наложить грелки, на грудь и спину горчичники, напоить пострадавшего горячим чаем или кофе.
При остановке дыхания необходимо прибегнуть к искусственной вентиляции легких в режиме гипервентиляции, введения дыхательных стимуляторов (лобелин гидрохлорид 1 мл 1% р-ра, цититон 1 мл). Применение карбогена и метиленового синего противопоказано. Необходимо также купировать судороги антиконвульсантами.
Фармакологическую коррекцию нарушений сердечной деятельности и профилактику угрожающих расстройств сердечного ритма и проводимости при остром отравлении угарным газом осуществляют с помощью унитиола 5-10 мл 5% р-ра, натрия тиосульфата 30-60 мл 30% р-ра, цитохрома С 25-50 мг витамина Е 1 мл 30% масляного раствора подкожно. Целесообразна инфузия 5-10% глюкозы с инсулином, витаминов группы В, аскорбиновой кислоты, глюкокортикоидов, например, внутривенно 90-120 мг преднизолона гемисукцината.
При наличии гипертермии показаны инъекции анальгина внутривенно 2 мл 50% раствора и краниоцеребральная гипотермия. При появлении признаков острой сосудистой недостаточности инъекции мезатона 0,5-1 мл 1% раствора, эфедрина гидрохлорида 1 мл 5% раствора. Этапность оказания медицинской помощи пострадавшему от оксида углерода представлена в таблице.
Этапы оказания медицинской помощи пострадавшим от отравления оксидом углерода (по данным П. Кондратенко, 2001)
| Лечебные мероприятия | Действия медперсонала | Лекарственные препараты и манипуляции |
| 1 | 2 | 3 |
| Первая и доврачебная помощь | Вынести пострадавшего на свежий воздух | В случае остановки сердца — непрямой массаж сердца и ИВЛ: дыхание «изо рта в нос» или «изо рта в рот» |
| Первая лекарственная помощь | Доставка пострадавшего в реанимационное отделение | Кордиамин или кофеин, или мезатон (по 1 мл 1% раствора внутримышечно). Кислота аскорбиновая — 20-30 мг в 20-50 мл 40% раствора глюкозы внутривенно; 500 мл 5% глюкозы с 50 мл 2% новокаина и с 20-30 мл 5% аскорбиновой кислоты внутривенно. Анальгин или Реопирин — внутримышечно, а также глюкокортикоиды. При остановке сердца — непрямой массаж сердца и ИВЛ: дыхание «изо рта в нос» или «изо рта в рот» |
| Квалифицированная медицинская помощь | ИВЛ с помощью аппаратов в режиме гипервентиляции, используя 100% подачу кислорода. Цитохром С — по 15-60 мг / сут. Антигипоксанты (натрия оксибутират), транквилизаторы или нейролептики, антигистаминные препараты внутривенно. Симптоматическая терапия. Глюкокортикоиды. |
Наиболее эффективным методом лечения острой интоксикации угарным газом является оксибаротерапия ( под давлением 2,5 атмосферы в течение 30-90 мин), поскольку вдыхание О2 под давлением резко ускоряет выделение СО из сыворотки, способствует исчезновению гемоциркуляторных расстройств, улучшению дыхания и деятельности сердца.
Хроническая интоксикация окисью углерода
При хроническом воздействии СО отравления наиболее часто встречаются в профессиональной среде.
Основные клинические проявления
- церебрастения,
- диэнцефалия,
- полиневрит,
- приступы стенокардии напряжения,
- тиреотоксикоз,
- импотенция,
- пернициозная анемия,
- полицитемия,
- спленомегалия и другие. После тяжелого отравления возникают последствия — ухудшение памяти и интеллекта.
Лечение
Сбор истории, которая вызвала острое отравление, прекращение контакта с СО, симптоматическое лечение, церебропротективное лечение с глюкозо-инсулиновыми вливаниями, витамины группы В, ферментные препараты, физиотерапия, реабилитация — физическая и психическая.
Автор:admin 21/02/2014 Яды кровиУгарный газ — это… Что такое Угарный газ?
Монооксид углерода (лат. Carbon monoxide; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
Регистрационные номера:
- ICSC 0023
- RTECS FG3500000
- ООН 1016
- EC 006-001-00-2
Классификация ООН
- Класс опасности ООН 2,3
- Вторичная опасность по классификации ООН 2,1
Строение молекулы
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2Oσ2zπ4x, yσ2C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
Молекула слабо поляризована, электрический момент её диполя μ = 0,04·10-29Кл·м (направление дипольного момента O—→C+). Ионизационный потенциал 14,0 в, силовая константа связи k = 18,6.
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Монооксид углерода в атмосфере Земли

Содержание CO в атмосфере Земли по данным MOPITT
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2C + O2 → 2CO↑ (тепловой эффект этой реакции 22 кДж),
2. или при восстановлении диоксида углерода раскалённым углём:
CO2 + C ↔ 2CO↑ (ΔH=172 кДж, ΔS=176 Дж/К).
Эта реакция часто происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ». Картина протекающих в печи реакций приведена на схеме.
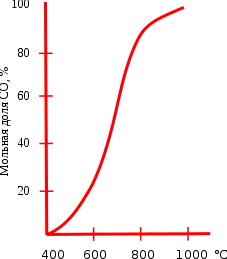
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
HCOOH →(t, H2SO4) H2O + CO↑
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
HCOOH + ClSO3H → H2SO4 + HCl + CO↑.
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
H2C2O4 →(t, H2SO4) CO↑ + CO2↑ + H2O.
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
K4[Fe(CN)6] + 6H2SO4 →(t) 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO↑.
Токсическое действие CO на человека
Физиологическое действие, токсичность
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаками отравления служат головная боль, головокружение и потеря сознания. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее, чем кислород (при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки кислорода и клеточного дыхания. Предельно допустимая концентрация монооксида углерода в воздухе промышленных предприятий составляет 0,02 мг/л. Концентрация более 0,1 % — смертельна. В выхлопе бензинового автомобиля допускается до 1,5-3 %.
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
Свойства
Монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
H2O + CO ↔ CO2 + H2 + 42 кДж
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
CO + 1/2O2 → 2CO2 ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
CO + Cl2 → COCl2
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
(FCO)2O2 + 2KI → 2KF + I2 + 2CO2↑
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
CO + S → COS ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
Восстанавливает SO2:
SO2 + 2CO → 2CO2 + S
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
CO + KOH → HCOOK
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
2K + 2CO → K+O——C2—O—K+
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
CO + NH3 → H2O + HCN
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
PdCl2 + H2O + CO → CO2 + 2HCl + Pd↓
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
5CO + I2O5 → 5CO2 + I2
Применение
- Моноксид углерода применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса (en:Clear smoke или en:Tasteless smoke технология). Допустимая концентрация CO равна 200 мг/кг мяса.
См. также
Литература
- Ахметов Н. С. Общая и неорганическая химия. 5-е изд., испр. — М.: Высш. шк.; 2003 ISBN 5-06-003363-5
- Некрасов Б. В. Основы общей химии. Т. I, изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. Стр. 495—497, 511—513
- Химия: Справ. из./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Перс. с нем. 2-е изд., стереотип. — М.:Химия, 2000 ISBN 5-7245-0360-3 (рус.)
Ссылки
Wikimedia Foundation. 2010.
Угарный газ [LifeBio.wiki]
Угарный газ, окись углерода (СО) представляет собой бесцветный газ без запаха и вкуса, который является немного менее плотным, чем воздух. Он токсичен для гемоглобинных животных (включая человека), если его концентрации выше примерно 35 частей на миллион, хотя он также производится в обычном метаболизме животных в небольших количествах, и, как полагают, имеет некоторые нормальные биологические функции. В атмосфере, он пространственно переменный и быстрораспадающийся, и имеет определенную роль в формировании озона на уровне земли. Окись углерода состоит из одного атома углерода и одного атома кислорода, связанных тройной связью, которая состоит из двух ковалентных связей, а также одной дативной ковалентной связи. Это самый простой оксид углерода. Он является изоэлектроном с цианидом аниона, нитрозоний катионом и молекулярным азотом. В координационных комплексах, лиганд монооксида углерода называется карбонилом.
История
Аристотель (384-322 до н.э.) впервые описал процесс сжигания углей, который приводит к образованию токсичных паров. В древности существовал способ казни – закрывать преступника в ванной комнате с тлеющими углями. Однако, на тот момент механизм смерти был непонятен. Греческий врач Гален (129-199 гг. н.э.) предположил, что имело место изменение состава воздуха, который причинял человеку вред при вдыхании. В 1776 году французский химик де Лассон произвел СО путем нагревания оксида цинка с коксом, однако ученый пришел к ошибочному выводу, что газообразный продукт был водородом, поскольку он горел синим пламенем. Газ был идентифицирован как соединение, содержащее углерод и кислород, шотландским химиком Уильямом Камберлендом Круикшанком в 1800 году. Его токсичность на собаках была тщательно исследована Клодом Бернаром около 1846 года. 1) Во время Второй мировой войны, газовая смесь, включающая окись углерода, использовалась для поддержания механических транспортных средств, работающих в некоторых частях мира, где было мало бензина и дизельного топлива. Внешний (с некоторыми исключениями) древесный уголь или газогенераторы газа, полученного из древесины, были установлены, и смесь атмосферного азота, окиси углерода и небольших количеств других газов, образующихся при газификации, поступала в газовый смеситель. Газовая смесь, полученная в результате этого процесса, известна как древесный газ. Окись углерода также использовалась в больших масштабах во время Холокоста в некоторых немецких нацистских лагерях смерти, наиболее явно – в газовых фургонах в Хелмно и в программе умерщвления Т4 «эвтаназия». 2)
Источники
Окись углерода образуется в ходе частичного окисления углеродсодержащих соединений; она образуется, когда не хватает кислорода для образования двуокиси углерода (CO2), например, при работе с плитой или двигателем внутреннего сгорания, в замкнутом пространстве. В присутствии кислорода, включая его концентрации в атмосфере, монооксид углерода горит голубым пламенем, производя углекислый газ. Каменноугольный газ, который широко использовался до 1960-х годов для внутреннего освещения, приготовления пищи и нагревания, содержал окись углерода как значительное топливное составляющее. Некоторые процессы в современной технологии, такие как выплавка чугуна, до сих пор производят окись углерода в качестве побочного продукта. Во всем мире наиболее крупными источниками окиси углерода являются естественные источники, из-за фотохимических реакций в тропосфере, которые генерируют около 5 × 1012 кг окиси углерода в год. Другие природные источники СО включают вулканы, лесные пожары и другие формы сгорания. В биологии, окись углерода естественным образом вырабатывается под действием гемоксигеназы 1 и 2 на гем от распада гемоглобина. Этот процесс производит определенное количество карбоксигемоглобина у нормальных людей, даже если они не вдыхают окись углерода. После первого доклада о том, что окись углерода является нормальным нейромедиатором в 1993 году, 3) а также одним из трех газов, которые естественным образом модулируют воспалительные реакции в организме (два других – оксид азота и сероводород), окись углерода получила большое внимание ученых в качестве биологического регулятора. Во многих тканях, все три газа, действуют как противовоспалительные средства, вазодилататоры и промоторы неоваскулярного роста. Продолжаются клинические испытания небольших количеств окиси углерода в качестве лекарственного средства. Тем не менее, чрезмерное количества монооксида углерода вызывает отравление угарным газом.
Молекулярные свойства
Окись углерода имеет молекулярную массу 28,0, что делает его немного легче, чем воздух, чья средняя молекулярная масса составляет 28,8. Согласно закону идеального газа, СО, следовательно, имеет меньшую плотность, чем воздух. Длина связи между атомом углерода и атомом кислорода составляет 112,8 пм. Эта длина связи согласуется с тройной связью, как в молекулярном азоте (N2), который имеет аналогичную длину связи и почти такую же молекулярную массу. Двойные связи углерод-кислород значительно длиннее, например, 120,8 м у формальдегида. Точка кипения (82 К) и температура плавления (68 K) очень похожи на N2 (77 К и 63 К, соответственно). Энергия диссоциации связи 1072 кДж / моль сильнее, чем у N2 (942 кДж / моль) и представляет собой наиболее сильную из известных химическую связь. Основное состояние электрона окиси углерода является синглетным 4), так как здесь нет неспаренных электронов.
Связующий и дипольный момент
Углерод и кислород вместе имеют, в общей сложности, 10 электронов в валентной оболочке. Следуя правилу октета для углерода и кислорода, два атома образуют тройную связь, с шестью общими электронами в трех связывающих молекулярных орбиталях, а не обычную двойную связь, как у органических карбонильных соединений. Так как четыре из общих электронов поступают из атома кислорода и только два из углерода, одна связующая орбиталь занята двумя электронами из атомов кислорода, образуя дативную или дипольную связь. Это приводит к C ← O поляризации молекулы, с небольшим отрицательным зарядом на углероде и небольшим положительным зарядом на кислороде. Две других связывающих орбитали занимают каждая один электрон из углерода и один из кислорода, образуя (полярные) ковалентные связи с обратной C → O поляризацией, так как кислород является более электроотрицательным, чем углерод. В свободной окиси углерода, чистый отрицательный заряд δ- остается в конце углерода, и молекула имеет небольшой дипольный момент 0,122 D. 5) Таким образом, молекула асимметрична: кислород имеет больше плотности электронов, чем углерод, а также небольшой положительный заряд, по сравнению с углеродом, который является отрицательным. В противоположность этому, изоэлектронная молекула диазота не имеет дипольного момента. Если окись углерода действует в качестве лиганда, полярность диполя может меняться с чистым отрицательным зарядом на конце кислорода, в зависимости от структуры координационного комплекса.
Полярность связи и состояние окисления
Теоретические и экспериментальные исследования показывают, что, несмотря на большую электроотрицательность кислорода, дипольный момент исходит из более отрицательного конца углерода к более положительному концу кислорода. 6) Эти три связи представляют собой фактически полярные ковалентные связи, которые сильно поляризованы. Рассчитанная поляризация к атому кислорода составляет 71% для σ-связи и 77% для обоих π -связей. Степень окисления углерода в окись углерода в каждой из этих структур составляет +2. Она рассчитывается так: все связующие электроны считаются принадлежащими к более электроотрицательным атомам кислорода. Только два несвязывающих электрона на углероде относятся к углероду. При таком подсчете, углерод имеет только два валентных электрона в молекуле по сравнению с четырьмя в свободном атоме.
Биологические и физиологические свойства
Токсичность
Отравление угарным газом является наиболее распространенным типом смертельного отравления воздуха во многих странах. 7) Окись углерода представляет собой бесцветное вещество, не имеющее запаха и вкуса, но очень токсичное. Оно соединяется с гемоглобином с получением карбоксигемоглобина, который «узурпирует» участок в гемоглобине, который обычно переносит кислород, но неэффективен для доставки кислорода к тканям организма. Столь низкие концентрации, как 667 частей на миллион, могут вызвать преобразования до 50% гемоглобина в организме в карбоксигемоглобин. [29] 50% уровень карбоксигемоглобина может привести к судорогам, коме и смерти. В Соединенных Штатах, Министерство труда ограничивает долгосрочные уровни воздействия окиси углерода на рабочем месте до 50 частей на миллион. В течение короткого периода времени, поглощение окиси углерода является накопительным, так как период его полувыведения составляет около 5 часов на свежем воздухе. Наиболее распространенные симптомы отравления угарным газом могут быть похожи на другие виды отравлений и инфекций, и включают такие симптомы, как головная боль, тошнота, рвота, головокружение, усталость и чувство слабости. Пострадавшие семьи часто считают, что они являются жертвами пищевого отравления. Младенцы могут быть раздражительными и плохо питаться. Неврологические симптомы включают спутанность сознания, дезориентацию, нарушение зрения, обмороки (потерю сознания) и судороги. Некоторые описания отравления угарным газом включают геморрагию сетчатки глаза, а также аномальный вишнево-красный оттенок крови. В большинстве клинических диагнозов, эти признаки наблюдаются редко. Одна из трудностей, связанных с полезностью этого «вишневого» эффекта, связана с тем, что она корректирует, или маскирует, в обратном случае нездоровый внешний вид, так как главный эффект удаления венозного гемоглобина связан с тем, что задушенный человек кажется более нормальным, или мертвый человек кажется живым, подобно эффекту красных красителей в составе для бальзамирования. Такой эффект окрашивания в бескислородной CO-отравленной ткани связан с коммерческим использованием монооксида углерода при окрашивании мяса. Оксид углерода также связывается с другими молекулами, такими как миоглобин и митохондриальная цитохромоксидаза. Воздействие окиси углерода может привести к значительному повреждению сердца и центральной нервной системы, особенно в бледном шаре, часто это связано с длительными хроническими патологическими состояниями. Окись углерода может иметь серьезные неблагоприятные последствия для плода беременной женщины. 8)
Нормальная физиология человека
Окись углерода вырабатывается естественным образом в организме человека в качестве сигнальной молекулы. Таким образом, окись углерода может иметь физиологическую роль в организме в качестве нейротрансмиттера или релаксанта кровеносных сосудов. Из-за роли окиси углерода в организме, нарушения в её метаболизме связаны с различными заболеваниями, в том числе нейродегенерацией, гипертонией, сердечной недостаточностью и воспалениями. 9)
CO функционирует в качестве эндогенной сигнальной молекулы.
СО модулирует функции сердечно-сосудистой системы
CO ингибирует агрегацию и адгезию тромбоцитов
CO может играть определенную роль в качестве потенциального терапевтического средства
Микробиология
Окись углерода является питательной средой для метаногенных архей, строительным блоком для ацетилкофермента А. Это тема для новой области биоорганометаллической химии. Экстремофильные микроорганизмы могут, таким образом, метаболизировать окись углерода в таких местах, как тепловые жерла вулканов. У бактерий, окись углерода производится путем восстановления двуокиси углерода ферментом дегидрогеназы монооксида углерода, Fe-Ni-S-содержащего белка. CooA представляет собой рецепторный белок окиси углерода. 10) Сфера его биологической активности до сих пор неизвестна. Он может быть частью сигнального пути у бактерий и архей. Его распространенность у млекопитающих не установлена.
Распространенность
Окись углерода встречается в различных природных и искусственных средах.
Содержание в атмосфере
Окись углерода присутствует в небольших количествах в атмосфере, главным образом, как продукт вулканической активности, но также является продуктом естественных и техногенных пожаров (например, лесные пожары, сжигание растительных остатков, а также сжигание сахарного тростника). Сжигание ископаемого топлива также способствует образованию окиси углерода. Окись углерода встречается в растворенном виде в расплавленных вулканических породах при высоких давлениях в мантии Земли. Поскольку природные источники окиси углерода переменны, чрезвычайно трудно точно измерить природные выбросы газа. Окись углерода является быстрораспадающимся парниковым газом, а также проявляет косвенное радиационное воздействие путем повышения концентрации метана и тропосферного озона в результате химических реакций с другими компонентами атмосферы (например, гидроксильный радикал, ОН), что, в противном случае, разрушило бы их. В результате естественных процессов в атмосфере, он, в конечном счете, окисляется до двуокиси углерода. Окись углерода является одновременно недолговечной в атмосфере (сохраняется в среднем около двух месяцев) и имеет пространственно переменную концентрацию. В атмосфере Венеры, окись углерода создается в результате фотодиссоциации двуокиси углерода электромагнитным излучением с длиной волны короче 169 нм. Из-за своей длительной жизнеспособности в средней тропосфере, окись углерода также используется в качестве трассера транспорта для струй вредных веществ.
Загрязнение городов
Окись углерода является временным загрязняющим веществом в атмосфере в некоторых городских районах, главным образом, из выхлопных труб двигателей внутреннего сгорания (в том числе транспортных средств, портативных и резервных генераторов, газонокосилок, моечных машин и т.д.), а также от неполного сгорания различных других видов топлива (включая дрова, уголь, древесный уголь, нефть, парафин, пропан, природный газ и мусор). Большие загрязнения CO могут наблюдаться из космоса над городами.
Роль в формировании приземного озона
Окись углерода, наряду с альдегидами, является частью серии циклов химических реакций, которые образуют фотохимический смог. Он вступает в реакцию с гидроксильным радикалом (• ОН) с получением радикального интермедиата • HOCO, который быстро передает радикальный водород О2 с образованием перекисного радикала (НО2 •) и диоксида углерода (CO2). Перекисной радикал затем вступает в реакцию с оксидом азота (NO) с образованием диоксида азота (NO2) и гидроксильного радикала. NO 2 дает O (3P) через фотолиз, тем самым образуя O3 после реакции с O2. Так как гидроксильный радикал образуется в процессе образования NO2, баланс последовательности химических реакций, начиная с окиси углерода, приводит к образованию озона: CO + 2O2 + hν → CO2 + O3 (Где hν относится к фотону света, поглощаемому молекулой NO2 в последовательности) Хотя создание NO2 является важным шагом, приводящим к образованию озона низкого уровня, это также увеличивает количество озона другим, несколько взаимоисключающим, образом, за счет уменьшения количества NO, которое доступно для реакции с озоном. 11)
Загрязнение воздуха внутри помещений
В закрытых средах, концентрация окиси углерода может легко увеличиться до летального уровня. В среднем, в Соединенных Штатах ежегодно от неавтомобильных потребительских товаров, производящих окись углерода, умирает 170 человек. Тем не менее, в соответствии с данными Департамента здравоохранения Флориды, «ежегодно более 500 американцев умирают от случайного воздействия окиси углерода и еще тысячи человек в США требуют неотложной медицинской помощи при несмертельном отравлении угарным газом». Эти продукты включают в себя неисправные топливные приборы сжигания, такие как печи, кухонные плиты, водонагреватели и газовые и керосиновые комнатные обогреватели; оборудование с механическим приводом, такое как портативные генераторы; камины; и древесный уголь, который сжигается в домах и других закрытых помещениях. Американская ассоциация центров контроля отравлений (AAPCC) сообщила о 15769 случаях отравления угарным газом, которые привели к 39 смертям в 2007 году. В 2005 году, CPSC сообщила о 94 смертях, связанных с отравлением моноксидом углерода от генератора. Сорок семь из этих смертей имели место во время перебоев в подаче электроэнергии из-за суровых погодных условий, в том числе, из-за урагана Катрина. Тем не менее, люди умирают от отравления угарным газом, производимым непродовольственными товарами, такими как автомобили, оставленные работающими в гаражах, прилегающих к дому. Центры по контролю и профилактике заболеваний сообщают, что ежегодно несколько тысяч человек обращаются в больницу скорой помощи при отравлении угарным газом. 12)
Наличие в крови
Окись углерода поглощается через дыхание и попадает в кровоток через газообмен в легких. Она также производится в ходе метаболизма гемоглобина и поступает в кровь из тканей, и, таким образом, присутствует во всех нормальных тканях, даже если она не попадает в организм при дыхании. Нормальные уровни окиси углерода, циркулирующие в крови, составляют от 0% до 3%, и выше у курильщиков. Уровни окиси углерода нельзя оценить с помощью физического осмотра. Лабораторные испытания требуют наличия образца крови (артериальной или венозной) и лабораторного анализа на СО-оксиметр. Кроме того, неинвазивный карбоксигемоглобин (SPCO) с импульсной СО-оксиметрией является более эффективным по сравнению с инвазивными методами.
Астрофизика
За пределами Земли, окись углерода является второй наиболее распространенной молекулой в межзвездной среде, после молекулярного водорода. Из-за своей асимметрии, молекула окиси углерода производит гораздо более яркие спектральные линии, чем молекула водорода, благодаря чему СО гораздо легче обнаружить. Межзвёздный CO был впервые обнаружен с помощью радиотелескопов в 1970 году. В настоящее время он является наиболее часто используемым индикатором молекулярного газа в межзвездной среде галактик, а молекулярный водород может быть обнаружен только с помощью ультрафиолетового света, что требует наличия космических телескопов. Наблюдения за окисью углерода обеспечивают большую часть информации о молекулярных облаках, в которых образуется большинство звезд. Beta Pictoris, вторая по яркости звезда в созвездии Pictor, демонстрирует избыток инфракрасного излучения по сравнению с нормальными звездами ее типа, что обусловлено большим количеством пыли и газа (в том числе окиси углерода) 13) вблизи звезды.
Производство
Было разработано множество методов для производства окиси углерода.
Промышленное производство
Основным промышленным источником CO является генераторный газ, смесь, содержащая, в основном, окись углерода и азот, образовавшийся при сгорании углерода в воздухе при высокой температуре, когда имеется избыток углерода. В печи, воздух пропускают через слой кокса. Первоначально произведенный СО2 уравновешивается с оставшимся горячим углем с получением СО. Реакция СО2 с углеродом с получением CO описывается как реакция Будуара. [63] При температуре выше 800°C, CO является преобладающим продуктом:
Другой источник «водяной газ», смесь водорода и монооксида углерода, полученного с помощью эндотермической реакции пара и углерода:
Другие подобные «синтетические газы» могут быть получены из природного газа и других видов топлива. Оксид углерода также является побочным продуктом восстановления руд оксида металла с углеродом:
Окись углерода также получают путем прямого окисления углерода в ограниченном количестве кислорода или воздуха.
Поскольку СО представляет собой газ, восстановительный процесс может управляться путем нагревания, используя положительную (благоприятную) энтропию реакции. Диаграмма Эллингама показывает, что образованию СО отдается предпочтение по сравнению с СО2 при высоких температурах.
Подготовка в лаборатории
Окись углерода удобно получать в лаборатории путем дегидратации муравьиной кислоты или щавелевой кислоты, например, с помощью концентрированной серной кислоты. Еще одним способом является нагревание однородной смеси порошкообразного металлического цинка и карбоната кальция, который высвобождает CO и оставляет оксид цинка и оксид кальция:
Нитрат серебра и иодоформ также дают окись углерода:
Координационная химия
Большинство металлов образуют координационные комплексы, содержащие ковалентно присоединенную окись углерода. Только металлы в низших степенях окисления будут соединяться с лигандами окиси углерода. Это связано с тем, что необходима достаточная плотность электронов, чтобы облегчить обратное пожертвование от металлической DXZ-орбитали, к π * молекулярной орбитали из СО. Неподеленная пара на атоме углерода в СО также жертвует электронную плотность в dx²-y² на металле для формирования сигма-связи. Это пожертвование электрона также проявляется цис-эффектом, или лабилизацией СО лигандов в цис-положении. Карбонил никеля, например, образуется путем прямого сочетания окиси углерода и металлического никеля:
По этой причине, никель в трубке или ее части не должен вступать в длительный контакт с окисью углерода. Карбонил никеля легко разлагается обратно до Ni и СО при контакте с горячими поверхностями, и этот метод используется для промышленной очистки никеля в процессе Монда. 14) В карбониле никеля и других карбонилах, электронная пара на углероде взаимодействует с металлом; окись углерода жертвует электронную пару металлу. В таких ситуациях, окись углерода называется карбонильным лигандом. Одним из наиболее важных карбонил металлов является пентакарбонил железа, Fe (CO) 5. Многие комплексы металл-CO получают путем декарбонилирования органических растворителей, а не из СО. Например, трихлорид иридия и трифенилфосфин реагируют в кипящем 2-метоксиэтаноле или ДМФ, с получением IrCl (CO) (PPh4) 2. Карбонилы металлов в координационной химии обычно изучаются с помощью инфракрасной спектроскопии.
Органическая химия и химия основных групп элементов
В присутствии сильных кислот и воды, окись углерода вступает в реакцию с алкенами с образованием карбоновых кислот в процессе, известном как реакции Коха-Хаафа. В реакции Гаттермана-Коха, арены преобразуются в бензальдегидные производные в присутствии AlCl3 и HCl. Литийорганические соединения (например, бутиллитий) вступают в реакцию с окисью углерода, но эти реакции мало научно применимы. Несмотря на то, что CO реагирует с карбокатионами и карбанионами, он относительно нереакционноспособен к органическим соединениям без вмешательства металлических катализаторов. С реагентами из основной группы, СО проходит несколько примечательных реакций. Хлорирование СО является промышленным процессом, приводящим к образованию важного соединения фосгена. С бораном, СО образует аддукт, h4BCO, который является изоэлектронным с катионом ацилия [h4CCO]+. СО вступает в реакцию с натрием, создавая продукты, полученные из связи С-С. Соединения циклогексагегексон или триквиноил (C6O6) и циклопентанепентон или лейконовая кислота (C5O5), которые до сих пор получали лишь в следовых количествах, можно рассматривать как полимеры окиси углерода. При давлении более 5 ГПа, окись углерода превращается в твердый полимер углерода и кислорода. Это метастабильное вещество при атмосферном давлении, но оно является мощным взрывчатым веществом. 15)
Использование
Химическая промышленность
Окись углерода представляет собой промышленный газ, который имеет множество применений в производстве сыпучих химических веществ. Большие количества альдегидов получают путем реакции гидроформилирования алкенов, окиси углерода и Н2. Гидроформилирование в процессе Шелла дает возможность создавать предшественники моющих средств. Фосген, пригодный для получения изоцианатов, поликарбонатов и полиуретанов, производится путем пропускания очищенного монооксида углерода и газообразного хлора через слой пористого активированного угля, который служит в качестве катализатора. Мировое производство этого соединения в 1989 году оценивалось в 2,74 млн тонн. 16)
Метанол получают путем гидрогенизации окиси углерода. В родственной реакции, гидрирование окиси углерода связано с образованием связи С-С, как в процессе Фишера-Тропша, где окись углерода гидрогенизируется до жидких углеводородных топлив. Эта технология позволяет преобразовывать уголь или биомассы в дизельное топливо. В процессе Монсанто, окись углерода и метанол реагируют в присутствии катализатора на основе родия и однородной иодистоводородной кислоты с образованием уксусной кислоты. Этот процесс отвечает за большую часть промышленного производства уксусной кислоты. В промышленных масштабах, чистая окись углерода используется для очистки никеля в процессе Монда.
Окраска мяса
Окись углерода используется в модифицированных атмосферных системах упаковки в США, в основном, при упаковке свежих мясных продуктов, таких как говядина, свинина и рыба, чтобы сохранять их свежий внешний вид. Окись углерода соединяется с миоглобином с образованием карбоксимиоглобина, ярко-вишнево-красного пигмента. Карбоксимиоглобин является более стабильным, чем окисленная форма миоглобина, оксимиоглобин, который может окислиться до коричневого пигмента метмиоглобина. Этот стабильный красный цвет может сохраняться гораздо дольше, чем обычное упакованное мясо. Типичные уровни окиси углерода, используемые в установках, использующих этот процесс, составляют от 0,4% до 0,5%. Эта технология впервые признана «в целом безопасной» (GRAS) Управлением по контролю за продуктами и лекарствами США (FDA) в 2002 году для использования в качестве вторичной упаковочной системы, и не требует маркировки. В 2004 году FDA одобрило CO в качестве основного метода упаковки, заявив, что CO не скрывает запаха порчи. Несмотря на это постановление, остается спорным вопрос о том, маскирует ли этот метод порчу продуктов. В 2007 году, в Палате представителей США был предложен законопроект, предлагающий называть модифицированный процесс упаковки с использованием окиси углерода цветовой добавкой, но законопроект не был принят. Такой процесс упаковки запрещен во многих других странах, включая Японию, Сингапур и страны Европейского Союза. 17)
Медицина
В биологии, окись углерода естественным образом вырабатывается под действием гемоксигеназы 1 и 2 на гем от распада гемоглобина. Этот процесс производит определенное количество карбоксигемоглобина у нормальных людей, даже если они не вдыхают окись углерода. После первого доклада о том, что окись углерода является нормальным нейромедиатором в 1993 году, а также одним из трех газов, которые естественным образом модулируют воспалительные реакции в организме (два других – оксид азота и сероводород), окись углерода получила большое клиническое внимание как биологический регулятор. Во многих тканях, все три газа, как известно, действуют как противовоспалительные средства, вазодилататоры и усилители неоваскулярного роста. Тем не менее, эти вопросы являются сложными, поскольку неоваскулярный рост не всегда полезен, так как он играет определенную роль в росте опухоли, а также в развитии влажной макулодистрофии, заболевания, риск которого увеличивается от 4 до 6 раз при курении (главный источник окиси углерода в крови, в несколько раз больше, чем естественное производство). Существует теория, что в некоторых синапсах нервных клеток, когда откладываются долгосрочные воспоминания, принимающая клетка вырабатывает окись углерода, которая обратно передается к передающей камере, заставляющей её передаваться более легко в будущем. Некоторые такие нервные клетки, как было показано, содержат гуанилатциклазу, фермент, который активируется окисью углерода. Во многих лабораториях по всему миру были проведены исследования с участием монооксида углерода относительно его противовоспалительных и цитопротекторных свойств. Эти свойства могут быть использованы для предотвращения развития ряда патологических состояний, в том числе, ишемического реперфузионного повреждения, отторжения трансплантата, атеросклероза, тяжелого сепсиса, тяжелой малярии или аутоиммунных заболеваний. Были проведены клинические испытания с участием людей, однако их результаты еще не были выпущены.
Лазеры
Оксид углерода также используется в качестве активной среды в мощных инфракрасных лазерах. 18)
Узкоспециализированное использование
Окись углерода была предложена для использования в качестве топлива на Марсе. Углеродные двигатели на окиси / кислороде были предложены для ранней поверхностной транспортации, так как монооксид углерода и кислород могут напрямую производиться из атмосферы Марса в ходе электролиза циркония, без использования каких-либо марсианских водных ресурсов для получения водорода, которые будут необходимы, чтобы создать метан или любое водородное топливо.
:Tags
Список использованной литературы:
1) Waring, Rosemary H.; Steventon, Glyn B.; Mitchell, Steve C. (2007). Molecules of death. Imperial College Press. p. 38. ISBN 1-86094-814-6. 2) Kitchen, Martin (2006). A history of modern Germany, 1800–2000. Wiley-Blackwell. p. 323. ISBN 1-4051-0041-9. 3) Kolata, Gina (January 26, 1993). «Carbon Monoxide Gas Is Used by Brain Cells As a Neurotransmitter». The New York Times. Retrieved May 2, 2010. 4) Vidal, C. R. (28 June 1997). «Highly Excited Triplet States of Carbon Monoxide». Archived from the original on 2006-08-28. Retrieved August 16, 2012. 5) Scuseria, Gustavo E.; Miller, Michael D.; Jensen, Frank; Geertsen, Jan (1991). «The dipole moment of carbon monoxide». J. Chem. Phys. 94 (10): 6660. Bibcode:1991JChPh..94.6660S. doi:10.1063/1.460293 6) Meerts, W; De Leeuw, F.H.; Dymanus, A. (1 June 1977). «Electric and magnetic properties of carbon monoxide by molecular-beam electric-resonance spectroscopy». Chemical Physics. 22 (2): 319–324. Bibcode:1977CP…..22..319M. doi:10.1016/0301-0104(77)87016-X 7) Omaye ST (2002). «Metabolic modulation of carbon monoxide toxicity». Toxicology. 180 (2): 139–150. doi:10.1016/S0300-483X(02)00387-6. PMID 12324190 8) Tucker Blackburn, Susan (2007). Maternal, fetal, & neonatal physiology: a clinical perspective. Elsevier Health Sciences. p. 325. ISBN 1-4160-2944-3. 9) Wu, L; Wang, R (December 2005). «Carbon Monoxide: Endogenous Production, Physiological Functions, and Pharmacological Applications». Pharmacol Rev. 57 (4): 585–630. doi:10.1124/pr.57.4.3. PMID 16382109 10) Roberts, G. P.; Youn, H.; Kerby, R. L. (2004). «CO-Sensing Mechanisms». Microbiology and Molecular Biology Reviews. 68 (3): 453–473. doi:10.1128/MMBR.68.3.453-473.2004. PMC 515253free to read. PMID 15353565 11) Ozone and other photochemical oxidants. National Academies. 1977. p. 23. ISBN 0-309-02531-1. 12) Centers for Disease Control and Prevention, National Environmental Public Health Tracking Network, Carbon Monoxide Poisoning, accessed 2009-12-04 13) Dent, W.R.F.; Wyatt, M.C.;Roberge, A.; Augereau,J.-C.; Casassus, S.;Corder, S.; Greaves, J.S.; de Gregorio-Monsalvo, I; Hales, A.; Jackson, A.P.; Hughes, A. Meredith; Lagrange, A.-M; Matthews, B.; Wilner, D. (March 6, 2014). «Molecular Gas Clumps from the Destruction of Icy Bodies in the β Pictoris Debris Disk». Science. 343: 1490–1492. arXiv:1404.1380free to read. Bibcode:2014Sci…343.1490D. doi:10.1126/science.1248726. Retrieved March 9, 2014. 14) Mond L, Langer K, Quincke F (1890). «Action of carbon monoxide on nickel». Journal of the Chemical Society. 57: 749–753. doi:10.1039/CT8905700749 15) Evans, W. J.; Lipp, M. J.; Yoo, C.-S.; Cynn, H.; Herberg, J. L.; Maxwell, R. S.; Nicol, M. F. (2006). «Pressure-Induced Polymerization of Carbon Monoxide: Disproportionation and Synthesis of an Energetic Lactonic Polymer». Chemistry of Materials. 18 (10): 2520–2531. doi:10.1021/cm0524446 16) Wolfgang Schneider; Werner Diller (2005), «Phosgene», Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a19_411 17) «CO in packaged meat». Carbon Monoxide Kills Campaign. Archived from the original on September 26, 2010. Retrieved November 2012. Check date values in: |access-date= (help) 18) Ionin, A.; Kinyaevskiy, I.; Klimachev, Y.; Kotkov, A.; Kozlov, A. (2012). «Novel mode-locked carbon monoxide laser system achieves high accuracy». SPIE Newsroom. doi:10.1117/2.1201112.004016
угарный_газ.txt · Последние изменения: 2016/09/08 16:34 — nataly
Угарный газ
Федеральное агентство по образованию Государственное образовательное учреждение Высшего профессионального образования «Уральский государственный педагогический университет»
Факультет «Безопасности жизнедеятельности»
Реферат
По дисциплине: Пожарная Безопасность
Тема: Влияние Угарного газа на организм человека
Исполнитель: Радостева АА
студентка БЭ-21
Преподаватель: Луконин ЕВ
Екатеринбург, 2014
Содержание:
Введение
Угарный газ
Взаимодействие угарного газа с другими веществами
Воздействие Фосгена на организм человека
Отравление угарным газом
Причины отравления угарным газом
Признаки отравления угарным газом
Профилактика отравления угарным газом
Оказание первой помощи при отравлении угарным газом
Заключение
Приложение
Список литературы
Введение
Угарный газ (СО) — один из наиболее токсичных компонентов продуктов горения, который входит в состав дыма, и выделяется при тлении и горении почти всех горючих веществ и материалов.
Ввиду своей токсичности угарный газ зачастую наносит крупный вред организму человека и тем обуславливает актуальность сего вопроса. Каждому человеку необходимо знать методы детоксикации после отравления угарным газом, а так же способы предотвращения отравления.
Целью работы выступает рассмотрение воздействия угарного газа и его соединений на организм человека. Для достижения этой цели ставятся задачи: Рассмотреть химическую формулу угарного газа и его соединений, указать наиболее частые причины отравления, способы детоксикации и оказания первой медицинской помощи, а так же методы профилактики во избежание отравления.
Монооксид углерода или угарный газ это бесцветный ядовитый газ (при нормальных условиях) без вкуса и запаха. Химическая формула — CO.
Молекула CO имеет тройную связь, как и молекула азота. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
Благодаря наличию тройной связи молекула CO весьма прочна и имеет малое межъядерное расстояние.
Оксид углерода(II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах.
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (например генераторный газ), используемых, в том числе, для отопления. В смеси с воздухом взрывоопасен; нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму).
Оксид углерода(II) был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем.
То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крюйкшенк. Токсичность газа была исследована в 1846 году французским медиком Клодом Бернаром в опытах на собаках.
Оксид углерода(II) вне атмосферы Земли впервые был обнаружен бельгийским учёным М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК-спектре Солнца. Оксид углерода(II) в межзвёздной среде был обнаружен в 1970 г.
Взаимодействие угарного газа с другими веществами
Основными типами химических реакций, в которых участвует оксид углерода(II), являются реакции присоединения иокислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах. Так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже.
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830 °C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции

до 830 °C смещено вправо, выше 830 °C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Оксид углерода(II) горит пламенем синего цвета (температура начала реакции 700 °C) на воздухе:
 (ΔG°298 =
−257 кДж, ΔS°298 =
−86 Дж/K).
(ΔG°298 =
−257 кДж, ΔS°298 =
−86 Дж/K).
Температура горения CO может достигать 2100 °C. Реакция горения является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления. В смеси с воздухом взрывоопасен; нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму).
Оксид углерода(II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:

Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида COF2, можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:

Оксид углерода(II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
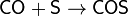 (ΔG°298 =
−229 кДж, ΔS°298 =
−134 Дж/K).
(ΔG°298 =
−229 кДж, ΔS°298 =
−134 Дж/K).
Получены также аналогичные селеноксид углерода COSe и теллуроксид углерода COTe.
Восстанавливает SO2:
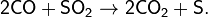
C переходными металлами образует горючие и ядовитые соединения — Карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др. Некоторые из них летучие.
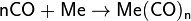
Оксид углерода(II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:

Интересна реакция оксида углерода(II) с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:

Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение —циановодород HCN. Реакция идёт в присутствии катализатора (диоксид тория ThO2) по уравнению:
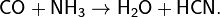
Важнейшим свойством оксида углерода(II) является его способность реагировать с водородом с образованием органических соединений:
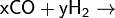 спирты
+ линейные алканы.
спирты
+ линейные алканы.
Этот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
Угарный газ: действие на организм человека
Признаки того, что угарный газ (оксид углерода(II), окись углерода, монооксид углерода) образовался в воздухе в опасной концентрации, определить сложно – невидимый, может не пахнуть, скапливается в помещении постепенно, незаметно. Для жизни человека чрезвычайно опасен: имеет высокую токсичность, излишнее содержание в легких приводит к тяжелым отравлениям и смертельным исходам. Ежегодно фиксируется высокий уровень смертности от отравления газом. Снизить угрозу отравления можно соблюдением простых правил и использованием специальных датчиков угарного вещества.
Статьи по темеЧто такое угарный газ
Природный газ образуется при горении любой биомассы, в промышленности является продуктом горения любых соединений на основе углерода. И в том, и в другом случае обязательным условием выделения газа является недостаток кислорода. Большие объемы его поступают в атмосферу в результате лесных пожаров, в виде выхлопных газов, образующихся при сгорании топлива в двигателях автомобилей. В промышленных целях используется при производстве органического спирта, сахара, обработке мяса животных и рыбы. Небольшое количество монооксида вырабатывают и клетки организма человека.
Свойства
С точки зрения химии monoxide – неорганическое соединение с единственным атомом кислорода в молекуле, химическая формула – СО. Это химическое вещество, которое не имеет характерного цвета, вкуса и запаха, оно легче воздуха, но тяжелее водорода, при комнатных температурах неактивно. Человек, ощущающий запах, чувствует лишь присутствие находящихся в воздухе органических примесей. Относится к разряду токсичных продуктов, смерть при концентрации в воздухе 0,1% наступает в течение одного часа. Характеристика предельно допустимой концентрации равна 20 мг/куб.м.


Действие угарного газа на организм человека
Для человека монооксид углерода представляет смертельную опасность. Его токсическое действие объясняется образованием в клетках крови карбоксигемоглобина – продукта присоединения оксида углерода(II) к гемоглобину крови. Высокий уровень содержания карбоксигемоглобина вызывает кислородное голодание, недостаточное поступление кислорода к головному мозгу и другим тканям организма. При слабой интоксикации содержание его в крови низкое, разрушение естественным путем возможно в течение 4-6 часов. При высоких концентрациях действуют только медицинские препараты.
Отравление угарным газом
Окись углерода – одно из самых опасных веществ. При отравлении происходит интоксикация организма, сопровождающаяся ухудшением общего состояния человека. Очень важно вовремя распознать признаки отравления угарным газом. Результат лечения зависит от уровня вещества в организме и от того, как скоро подоспела помощь. В этом деле счет идет на минуты – пострадавший может или вылечиться окончательно, или остаться больным навсегда (все зависит от скорости реагирования спасателей).
Симптомы
В зависимости от степени отравления могут наблюдаться головные боли, головокружения, шум в ушах, учащенное сердцебиение, тошнота, одышка, мерцание в глазах, общая слабость. Часто наблюдается сонливость, что особенно опасно, когда человек находится в загазованном помещении. При попадании в органы дыхания большого количества ядовитых веществ наблюдаются судороги, потеря сознания, в особо тяжелых случаях – кома.


Первая помощь при отравлении угарным газом
Пострадавшему на месте должна быть оказана доврачебная помощь при отравлении угарным газом. Надо незамедлительно переместить его на свежий воздух и вызвать врача. Следует помнить и о своей безопасности: заходить в помещение с источником этого вещества надо только глубоко вдохнув, внутри не дышать. Пока не приехал врач надо облегчить доступ кислорода к легким: расстегнуть пуговицы, снять или ослабить одежду. Если потерпевший потерял сознание и перестал дышать, необходима искусственная вентиляция легких.
Антидот при отравлении
Специальное противоядие (антидот) при отравлении окисью углерода – это медикаментозный препарат, который активно препятствует образованию карбоксигемоглобина. Действие антидота приводит к снижению потребности организма в кислороде, поддержке органов, чувствительных к недостатку кислорода: головного мозга, печени и др. Вводится внутримышечно дозировкой 1 мл сразу после извлечения больного из зоны с высокой концентрацией ядовитых веществ. Повторно можно вводить антидот не ранее чем через час после первого введения. Допускается его использование для профилактики.
Лечение
В случае легкого воздействия окисью углерода лечение проводится амбулаторно, в тяжелых случаях больной госпитализируется. Уже в карете скорой помощи ему дается кислородная подушка или маска. В тяжелых случаях, чтобы дать организму большую дозу кислорода, пациента помещают в барокамеру. Внутримышечно вводится антидот. Уровень газа в крови постоянно контролируется. Дальнейшая реабилитация медикаментозная, действия врачей направлены на восстановление работы головного мозга, сердечно-сосудистой системы, легких.


Последствия
Воздействие угарным углеродом на организм может стать причиной серьезных заболеваний: изменяются работоспособность мозга, поведение, сознание человека, появляются необъяснимые головные боли. Особенно влиянию вредных веществ подвержена память – та часть головного мозга, которая отвечает за переход кратковременной памяти в долговременную. Последствия отравления угарным газом больной может почувствовать только спустя несколько недель. Большинство пострадавших полностью восстанавливаются после периода реабилитации, но некоторые ощущают последствия всю жизнь.
Как определить угарный газ в помещении
Отравиться окисью углерода легко в домашних условиях, и это случается не только во время пожара. Концентрация угарного углерода образуется при неаккуратном обращении с заслонкой печи, при эксплуатации неисправной газовой колонки или вентиляции. Источником угарного вещества может быть газовая плита. Если в помещении стоит дым – это уже повод бить тревогу. Для постоянного контроля за уровнем газа существуют специальные датчики. Они контролируют уровень концентрации газа и сообщают о превышении нормы. Наличие такого прибора снижает риск отравления.
Видео
 Опасности вашего дома. Угарный газ
Опасности вашего дома. Угарный газ
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим! Рассказать друзьям:Угарный газ: формула, вред, датчик
О том, насколько опасен угарный газ для человека, знают все, кому приходилось сталкиваться с работой отопительных систем, — печек, котлов, бойлеров, водогрейных колонок, рассчитанных на бытовое топливо в любой его форме. Нейтрализовать его в газовом состоянии довольно сложно, эффективных домашних способов бороться с угарным газом не существует, поэтому большая часть защитных мероприятий направлена на предупреждение и своевременное выявление угара в воздухе.


Свойства токсичного вещества
В природе и свойствах угарного газа нет ничего необычного. По сути, это продукт частичного окисления угля или угольсодержащих видов топлива. Формула угарного газа проста и незамысловата – СО, в химических терминах — монооксид углерода. Один атом углерода соединен с атомом кислорода. Так уж устроена природа процессов горения органического топлива, что угарный газ является неотъемлемой частью любого пламени.


Угли, родственные им виды топлива, торф, дрова при нагреве в топке газифицируются в угарный газ, и только потом дожигаются притоком воздуха. Если угар просочился из камеры горения в помещение, то он будет оставаться в стабильном состоянии до момента, когда вентиляцией угарный поток будет вынесен из комнаты или накапливаться, заполняя все пространство, от пола до потолка. В последнем случае спасти положение может только электронный датчик угарного газа, реагирующий на малейшее повышение концентрации токсичного угара в атмосфере помещения.
Что необходимо знать об угарном газе:
- В стандартных условиях плотность угарного газа – 1,25 кг/м3, что очень близко к удельному весу воздуха 1,25 кг/м3. Горячий и даже теплый монооксид легко поднимается под потолок, по мере остывания оседает и перемешивается с воздухом;
- Угарный газ не имеет вкуса, цвета и запаха, даже в условиях высокой концентрации;
- Для начала образования угарного газа достаточно нагреть металл, контактирующий с углеродом, до температуры в 400-500оС;
- Газ способен гореть в воздухе с выделением большого количества тепла, примерно 111 кДж/моль.
Опасно не только вдыхание угарного газа, газовоздушная смесь способна взрываться при достижении объемной концентрации от 12,5% до 74%. В этом смысле газовая смесь похожа на бытовой метан, но гораздо опаснее сетевого газа.


Метан легче воздуха и менее токсичен при вдыхании, кроме того, благодаря добавке в газовый поток специальной присадки – меркаптана, его наличие в помещении легко уловить по запаху. При небольшой загазованности кухни можно без последствий для здоровья войти в помещение и проветрить его.
С угарным газом все сложнее. Близкое родство СО и воздуха препятствует эффективному удалению токсичного газового облака. По мере охлаждения облако газа будет постепенно оседать в области пола. Если сработал датчик угарного газа, или обнаружилась утечка продуктов горения из печи или котла на твердом топливе, необходимо немедленно принимать меры к проветриванию, иначе первыми пострадают дети и домашние питомцы.
Подобное свойство угарного облака ранее широко использовалось для борьбы с грызунами и тараканами, но эффективность газовой атаки значительно ниже современных средств, а риск заработать отравление несоизмеримо выше.
К сведению! Газовое облако СО, при отсутствии вентиляции, способно сохранять свои свойства без изменений длительное время.
При наличии подозрения в накоплении угарного газа в подвальных помещения, подсобках, котельных, погребах первым делом необходимо обеспечить максимальное проветривание с кратностью газообмена 3-4 единицы в течение часа.
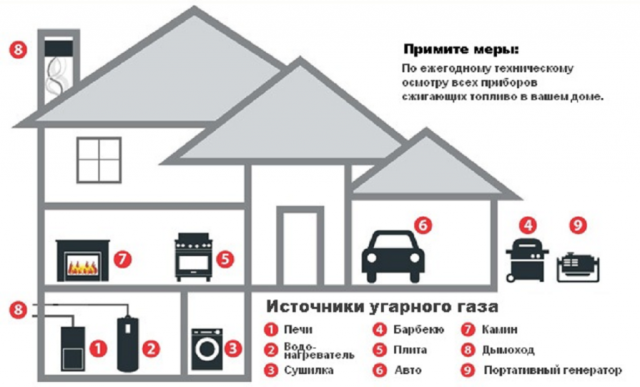

Условия появления угара в помещении
Монооксид углерода можно получить с помощью десятков вариантов химических реакций, но для этого необходимы специфические реактивы и условия их взаимодействия. Риск заработать отравление газом таким способом практически равен нулю. Основными причинами появления угарного газа в котельной или в помещении кухни остаются два фактора:
- Плохая тяга и частичное перетекание продуктов горения из очага горения в помещение кухни;
- Неправильная эксплуатация котельного, газового и печного оборудования;
- Пожары и локальные очаги возгорания пластика, проводки, полимерных покрытий и материалов;
- Отходящие газы из канализационных коммуникаций.
Источником угарного газа может стать вторичное горение золы, рыхлых отложений сажи в дымоходах, копоть и смола, въевшиеся в кирпичную кладку каминных полок и сажегасителей.


Чаще всего источником газового СО становятся тлеющие угли, догорающие в топке при закрытой задвижке. Особенно много выделяется газа при термическом разложении дров в отсутствии воздуха, примерно половину газового облака занимает угарный газ. Поэтому любые эксперименты с копчением мяса и рыбы на дымке, получаемом от тлеющей стружки, должны выполняться только на открытом воздухе.
Незначительное количество угарного газа может появляться и в процессе приготовления пищи. Например, все, кто сталкивался с установкой на кухне газовых отопительных котлов с закрытой топкой, знают, как реагируют датчики угарного газа на жареную картошку или любые продукты, приготовленные в кипящем масле.


Коварный характер угарного газа
Главная опасность монооксида углерода заключается в том, что невозможно ощутить и почувствовать его присутствие в атмосфере помещения до того момента, как газ попадет с воздухом в органы дыхания и растворится в крови.


Последствия от вдыхания СО зависят от концентрации газа в воздухе и длительности пребывания в помещении:
- Головная боль, недомогание и развитие сонливого состояния начинается при объемном содержании газа в воздухе 0,009-0,011%. Физически здоровый человек способен выдержать до трех часов пребывания в загазованной атмосфере;
- Тошнота, сильная боль в мышцах, судороги, обмороки, потеря ориентации могут развиться при концентрации 0,065-0,07%. Время пребывания в помещении до момента наступления неотвратимых последствий всего1,5-2 ч;
- При концентрации угарного газа выше 0,5% даже несколько секунд пребывания в загазованном пространстве означают летальный исход.
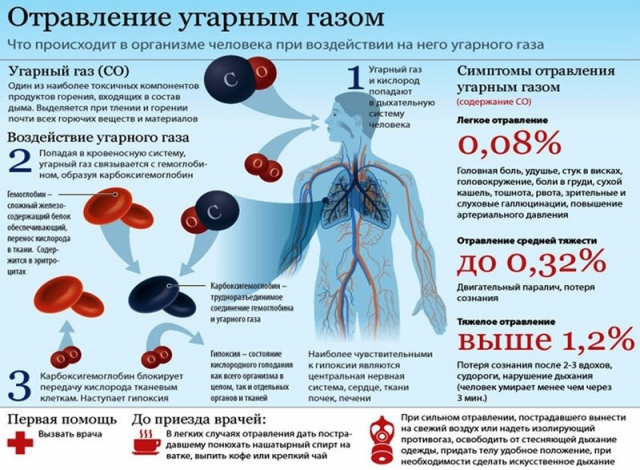

Даже если человек благополучно самостоятельно выбрался из помещения с высокой концентрацией угарного газа, все равно потребуется медицинская помощь и использование антидотов, так как последствия отравления кровеносной системы и нарушения кровообращения мозга все равно проявятся, только чуть позже.
Молекулы угарного газа хорошо поглощаются водой и солевыми растворами. Поэтому в качестве первого подручного средства защиты нередко используются обычные полотенца, салфетки, смоченные любой доступной водой. Это позволяет остановить попадание угарного газа в организм на несколько минут, пока появится возможность покинуть помещение.
Нередко этим свойством монооксида углерода злоупотребляют некоторые владельцы отопительной аппаратуры, в которой встроены датчики СО. При срабатывании чувствительного сенсора, вместо проветривания помещения, зачастую прибор просто накрывают мокрым полотенцем. Как результат, после десятка подобных манипуляций датчик угарного газа выходит из строя, и на порядок возрастает риск заработать отравление.
Технические системы регистрации угарного газа
По сути, сегодня существует только один способ успешно бороться с угарным газом, использовать специальные электронные приборы и датчики, регистрирующие превышение концентрации СО в помещении. Можно, конечно, поступить проще, например, обустроить мощную вентиляцию, как это делают любители отдыха у настоящего кирпичного камина. Но в подобном решении есть определенный риск заработать отравление угарным газом при смене направления тяги в трубе, а кроме того, жить под сильным сквозняком тоже не очень полезно для здоровья.


Устройство датчиков наличия угарного газа
Проблема контроля над содержанием угарного газа в атмосфере жилых и подсобных помещений на сегодня настолько же злободневна, как и наличие пожарной или охранной сигнализации.
В специализированных салонах отопительного и газового оборудования можно приобрести несколько вариантов приборов контроля над содержанием газа:
- Химические сигнализаторы;
- Инфракрасные сканеры;
- Твердотельные датчики.
Чувствительный сенсор прибора обычно комплектуется электронной платой, обеспечивающей питание, калибровку и преобразование сигнала в понятную форму индикации. Это могут быть просто зеленые и красные светодиоды на панели, звуковая сирена, цифровая информация для выдачи сигнала в компьютерную сеть или управляющий импульс для автоматического клапана, перекрывающего подачу бытового газа к отопительному котлу.


Понятно, что использование датчиков с управляемым запирающим клапаном является вынужденной мерой, но зачастую производители отопительного оборудования намеренно встраивают «защиту от дурака», чтобы избежать всевозможных манипуляций с безопасностью газового оборудования.
Химические и твердотельные приборы контроля
Наиболее дешевая и доступная версия датчика с химическим индикатором изготавливается в виде сетчатой колбы, легко проницаемой для воздуха. Внутри колбы находится два электрода, разделенных пористой перегородкой, пропитанной раствором щелочи. Появление угарного газа приводит к карбонизации электролита, проводимость сенсора резко падает, что немедленно считывается электроникой в качестве сигнала тревоги. После установки прибор находится в неактивном состоянии и не срабатывает до тех пор, пока в воздухе не появятся следы угарного газа, превышающие допустимую концентрацию.
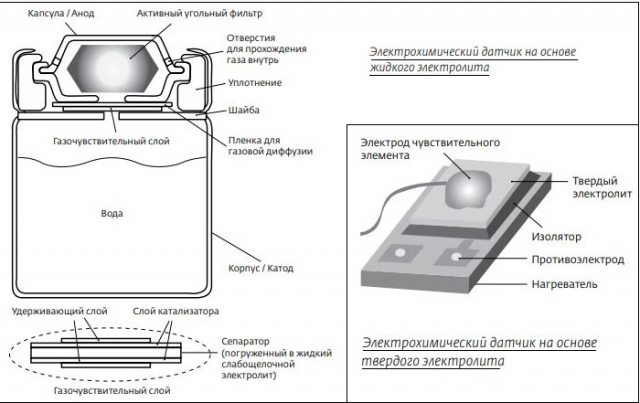

В твердотельных датчиках вместо пропитанного щелочью куска асбеста используются двухслойные пакеты из диоксидов олова и рутения. Появление газа в воздухе вызывает пробой между контактами сенсорного устройства и автоматически запускает сигнал тревоги.


Сканеры и электронные сторожа
Инфракрасные датчики, работающие по принципу сканирования окружающего воздуха. Встроенный инфракрасный сенсор воспринимает свечение лазерного светодиода, и по изменению интенсивности поглощения газом теплового излучения срабатывает триггерное устройство.


СО очень хорошо поглощает тепловую часть спектра, поэтому подобные приборы работают в режиме сторожа или сканера. Результат сканирования может выдаваться в виде двухцветного сигнала или индикации величины содержания угарного газа в воздухе на цифровой или линейной шкале.
Какой датчик лучше
Для правильного подбора сенсора наличия угарного газа необходимо учитывать режим работы и характер помещения, в котором предстоит установить сенсорное устройство. Например, химические датчики, считающиеся устаревшими, прекрасно работают в условиях котельных и подсобных помещений. Недорогой прибор для обнаружения угарного газа можно установить на даче или в мастерской. На кухне сетка быстро покрывается пылью и жировыми отложениями, что резко снижает чувствительность химической колбочки.
Полупроводниковые сенсоры угарного газа работают одинаково хорошо в любых условиях, но для их функционирования требуется мощный внешний источник питания. Стоимость прибора выше, чем цена на химические сенсорные системы.


Инфракрасные датчики на сегодня наиболее распространены. Они активно используются для комплектации систем безопасности квартирных котлов индивидуального отопления. При этом чувствительность системы контроля практически не меняется с течением времени из-за пыли или температуры воздуха. Мало того, такие системы, как правило, имеют встроенные механизмы тестирования и калибровки, что позволяет периодически проверять их работоспособность.
Установка приборов контроля над содержанием угарного газа
Сенсоры, осуществляющие контроль над содержанием угарного газа, должны устанавливаться и обслуживаться исключительно профильными специалистами. Периодически приборы подлежат проверке, калибровке, обслуживанию и замене.

Датчик должен устанавливаться на удалении от источника газа от 1 до 4 м, корпус или выносные сенсоры крепятся на высоте 150 см над уровнем пола и обязательно калибруются по верхнему и нижнему порогу чувствительности.
Срок службы квартирных датчиков угарного газа составляет 5 лет.
Заключение
Борьба с образованием угарного газа требует аккуратности и ответственного отношения к установленной аппаратуре. Любые эксперименты с сенсорами, особенно полупроводникового типа, резко снижают чувствительность прибора, что в конечном итоге приводит к увеличению содержания угарного газа в атмосфере кухни и всей квартиры, медленному отравлению всех ее обитателей. Проблема контроля угарного газа настолько серьезна, что, возможно, использование сенсоров в будущем могут сделать обязательным для всех категорий индивидуального отопления.

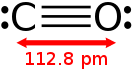
 (
(