ПДК вредных веществ в атмосферном воздухе
В городах воздух очень сильно загрязняют вредные выбросы автотранспорта и промышленных предприятий, выбрасывающих целую гамму веществ, каждое из которых с разной степенью интенсивности отрицательно влияет на здоровье человека.
 Для всех, загрязняющих веществ существуют нормы ПДК (предельно допустимых концентраций) веществ в воздухе. За соблюдением этих норм должны следить специальные органы (в Москве это ГПУ «Мосэкомониторинг» ) и в случае систематического их нарушения накладывать определенные санкции: от штрафа до закрытия предприятия.
Для всех, загрязняющих веществ существуют нормы ПДК (предельно допустимых концентраций) веществ в воздухе. За соблюдением этих норм должны следить специальные органы (в Москве это ГПУ «Мосэкомониторинг» ) и в случае систематического их нарушения накладывать определенные санкции: от штрафа до закрытия предприятия.
На данной странице приведены краткие характеристики некоторых наиболее распространенных вредных веществ, выбрасываемых в воздух автотранспортом и промышленными предприятиями.
Класс опасности вредных веществ — условная величина, предназначенная для упрощённой классификации потенциально опасных веществ.
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности:
I вещества чрезвычайно опасные
II вещества высокоопасные
III вещества умеренно опасные
IV вещества малоопасные
ПДК — предельная допустимая концентрация загрязняющего вещества в атмосферном воздухе – концентрация, не оказывающая в течение всей жизни прямого или косвенного неблагоприятного действия на настоящее или будущее поколение, не снижающая работоспособности человека, не ухудшающая его самочувствия и санитарно-бытовых условий жизни.
ПДКсс – предельно допустимая среднесуточная концентрация химического вещества в воздухе населенных мест, мг/м3. Эта концентрация не должна оказывать на человека прямого или косвенного вредного воздействия при неопределенно долгом (годы) вдыхании.
Характеристики вредных веществ.
Сернистый ангидрид (диоксид серы) SO2
Класс опасности — 3
ПДКсс — 0,05
ПДКмр — 0,5
Бесцветный газ с характерным резким запахом. Токсичен.
В лёгких случаях отравления сернистым ангидридом появляются кашель, насморк, слезотечение, чувство сухости в горле, осиплость, боль в груди; при острых отравлениях средней тяжести, кроме того, головная боль, головокружение, общая слабость, боль в подложечной области; при осмотре — признаки химического ожога слизистых оболочек дыхательных путей.
Длительное воздействие сернистого ангидрида может вызвать хроническое отравление. Оно проявляется атрофическим Ринитом, поражением зубов, часто обостряющимся токсическим бронхитом с приступами удушья. Возможны поражение печени, системы крови, развитие пневмосклероза.
Диоксид серы образуется при использовании резервных видов топлива предприятиями теплоэнергетического комплекса (мазут, уголь, газ низкого качества) и выбросов дизельного автотранспорта.
Азота оксид (окись азота) NO.
Класс опасности -
ПДКсс — 0,06
ПДКмр — 0,4
Бесцветный газ со слабым сладковатым запахом, известен под названием «веселящий газ», т.к. значительные количества его возбуждающе действуют на нервную систему. В смеси с кислородом применяют для наркоза в легких операциях.
Соединение обладает положительным биологическим действием. NO является важнейшим биологическим проводником, способным вызывать на клеточном уровне большое количество позитивных изменений, что приводит к улучшению кровообращения, иммунной и нервной систем.
Азота диоксид (двуоокись азота) NO2
Класс опасности — 2
ПДКсс — 0,04
ПДКмр — 0,085
При высоких концентрациях бурый газ с удушливым запахом. Действует как острый раздражитель. Однако при тех концентрациях, которые присутствуют в атмосфере, NO2 является скорее потенциальным раздражителем и только потенциально ее можно сравнивать с хроническими легочными заболеваниями. Однако у детей в возрасте 2 -3 года наблюдался некоторый рост заболеваний бронхитом.
Под воздействием солнечной радиации и при наличии несгоревших углеводородов окислы азота вступают в реакции с образованием фотохимического смога.
Углерода окись СО (угарный газ)
Класс опасности — 4
ПДКсс — 0,05
ПДКмр — 0,15
Газ без цвета и запаха. Токсичен. При острых отравлениях головная боль, головокружение, тошнота, слабость, одышка, учащенный пульс. Возможна потеря сознания, судороги, кома, нарушение кровообращения и дыхания.
При хронических отравлениях появляются головная боль, бессонница, возникает эмоциональная неустойчивость, ухудшаются внимание и память. Возможны органические поражения нервной системы, сосудистые спазмы
Углерода окись образуется в результате неполного сгорания углерода в топливе. В частности при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода. Подобное образование происходит в печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть, отсюда и одно из тназваний — «угарный газ»
Углерода двуокись (углекислый газ) СО2
Бесцветный газ со слабым кисловатым запахом. Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье. Вызывает гипоксию (длительностью до нескольких суток), головные боли, головокружение, тошноту (конц 1.5 — 3%). При конц. выше 61% теряется работоспособность, появляется сонливость, ослабление дыхания, сердечной деятельности, возникает опасность для жизни.
Ванадия пятиокись V2O5.
Класс опасности — 1
ПДКсс — 0,002
Ядовита. Вызывает раздражение дыхательных путей, легочные кровотечения, головокружение, нарушение деятельности сердца, почек и т.д. Канцероген.
Соединение образуется в небольших количествах при сжигании мазута.
Сероуглерод (дисульфид углерода) CS2, бесцветная жидкость с неприятным запахом.
Класс опасности — 2
ПДКсс — 0,005
ПДКмр — 0,03
Пары сероуглерода ядовиты и очень легко воспламеняются. Действует на центральную и переферическую нервные системы, сосуды, обменные процессы.
При легких отравлениях — наркотическое действие, головокружение. При отравлении средней тяжести возникает возбуждение с возможным переходом в кому. При хроничнской интоксикации возникают нервно сосудистые растройства, нарушение психики, сна и т.д.
Ксилол (диметилбензол)
Класс опасности — 3
ПДКсс — 0,2
ПДКмр — 0,2
Образует взрывоопасные паровоздушные смеси.
Вызывает острые и хронические поражения кроветворных органов, дистрофические изменения в печени и почках, при контактах с кожей — дерматиты.
Бензол
Класс опасности — 2
ПДКсс — 0,1
ПДКмр — 1,5
Бесцветная летучая жидкость со своеобразным нерезким запахом.
При острых отравлениях наблюдается головная боль, гоовокружение, тошнота, рвота, возбуждение сменяющееся угнетенным состоянием, частый пульс, падение кровяного давления. В тяжелых случаях — судороги, потеря сознания.
Хронические отравления проявляются изменением крови (нарушение функции костного мозга), головокружением, общей слабостью, расстройством сна, быстрой утомляемостью. У женщин — нарушение менструальной функции.
Бензпирен, бенз(а)пирен
Класс опасности — 1
ПДКсс — 0,01
Образуется при сгорании углеводородного жидкого, твёрдого и газообразного топлива (в меньшей степени ри сгорании газообразного).Может появиться в дымовых газах при сжигании любого топлива с недостатком кислорода в отдельных зонах горения.
Бенз(а)пирен является наиболее типичным химическим канцерогеном окружающей среды, он опасен для человека даже при малой концентрации, поскольку обладает свойством биоаккумуляции. Будучи химически сравнительно устойчивым, бенз(а)пирен может долго мигрировать из одних объектов в другие. В результате многие объекты и процессы окружающей среды, сами не обладающие способностью синтезировать бенз(а)пирен, становятся его вторичными источниками. Бенз(а)пирен оказывает также мутагенное действие.
Толуол (метилбензол)
Класс опасности — 3
ПДКсс — 0,6
ПДКмр — 0,06
Бесцветная горючая жидкость.
Пределы взрываемой смеси с воздухом 1.3 — 7%.
Толуол (метилбензол) — является сильно токсичным ядом, влияющим на функцию кроветворения организма, также, как и его предшественник, бензол. Нарушение кроветворения проявляется в цианозе, гипоксии.
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое
Хлор
Класс опасности — 2
ПДКсс — 0,03
ПДКмр — 0,1
Желто-зеленый газ с резким раздражающим запахом. Раздражает слизистые оболочки глаз и дыхательных путей. К первичным воспалительным прцессам обычно присоединяется вторичная инфекция. Острые отравления развиваются почти намедленно. При вдыхании средних и низких концентраций отмечаются стеснение и боль в груди, учащенное дыхание, резь в глазах, слезотечение, повышенное содержание лейкоцитов в крови, температуры тела и т.п. Возможны бронхопневмония, отек легких, депрессивное состояние, судороги. Как отдаленные последствия наблюдаются катары верхних дыхательных путей, бронхит, пневмосклероз и др. Возможна активизация туберкулеза. При длительном вдыхании небольших концентраций наблюдаются аналогичные, но медленно развивающиеся формы заболевания.
Хром шестивалентный
Класс опасности — 1
ПДКсс — 0,0015
ПДКмр — 0,0015
Токсичен. Начальные формы заболевания проявляются ощуще¬нием сухости и болью в носу, першением в горле, затруднением дыхания, кашлем и т.д. При длительном контакте развиваются признаки хронического отравления: головная боль, слабость, диспепсия, потеря в весе и др. Нарушаются функции желудка, пе¬чени и поджелудочной железы. Возможны бронхит, астма, диффузный пневмосклероз. При воздействии на кожу могут развиваться дерматиты, экземы.
Соединения хрома обладают КАНЦЕРОГЕННЫМ действием.
Сажа
Класс опасности — 3
ПДКсс — 0,5
ПДКмр — 0,15
Дисперсный углеродный продукт неполнго сгорания. Сажевые частицы не взаимодействуют с кислородом воздуха и поэтому удаля¬ются только за счет коагуляции и осаждения, которые идут очень медленно. Поэтому, для сохранения чистоты окружающей среды нужен очень жесткий контроль за выбросами сажи.
Канцеpоген, способствует возникновению pака кожи.
Озон (О3)
Класс опасности — 1
ПДКсс — 0,03
ПДКмр — 0,16
Взрывчатый газ синего цвета с резким характерным запахом. Убивает микроорганизмы, поэтому его применяют для очистки воды и воздуха (озонирование). Однако в воздухе допустимы лишь очень малые концентрации т.к. озон чрезвычайно ядовит (более чем угарный газ СО).
Свинец и его соединения (кроме тетраэтилсвинца)
Класс опасности — 1
ПДКсс — 0,0003
Ядовит, воздействует на центpальную неpвную систему, даже малые дозы свинца вызывают у детей отставание в pазвитии интеллекта. Поражение нервной системы проявляется астенией, при выраженных формах — энцефалопатией, параличами (преимущественно разгибателей кистей и пальцев рук), полиневризмом.
При хронической интоксикации возможны поражения печени, сердечно-сосудистой системы, нарушение эндокринных функций (например, у женщин — выкидыши). Угнетение иммуннобиологической реактивности способствует повышенной общей заболеваемости. Возможны и смеpтельные отpавления.
Свинец влияет на нервную систему человека, что приводит к снижению
интеллекта, вызывает изменение физической активности, координации слуха,
воздействует на сердечно-сосудистую систему, приводя к заболеванию сердца.
Это оказывает негативное влияние на состояние здоровья населения и в первую
очередь детей, которые наиболее восприимчивы к свинцовым отравлениям.
Канцероген, мутаген.
Тетроэтилсвинец
ОБУВ — 0,000003
Горюч.
При температуре выше 77°C могут образоваться взрывоопасныe смеси пар/воздух.
Вещество раздражает глаза, кожу, дыхательные пути. Вещество может оказывать действие на центральную нервную систему , приводя к раздражительности, бессоннице, сердечным расстройствам. Воздействие может вызывать помутнение сознания. Воздействие высоких концентраций может вызвать смерть. Показано медицинское наблюдение.
При долговременном или многократном воздействии может оказать токсическое действие на репродуктивную функцию человека.
Формальдегид HCOH
Бесцветный газ с резким запахом.
Токсичен, оказывает отрицательное влияние на генетику, органы дыхания, зрения и кожный покров. Оказывает сильное воздействие на нервную систему. Формальдегид занесен в список канцерогенных веществ.
Вещество может оказывать действие на печень и почки, приводя к функциональным нарушениям
Применяют формальдегид при изготовлении пластмасс, а основная часть формальдегида идет на изготовление ДСП и других древесностружечных материалов. В них феноло-формальдегидная смола составляет 6-18% от массы стружек.
Фенол
Фенол – летучее вещество с характерным резким запахом. Пары его ядовиты. При попадании на кожу фенол вызывает болезненные ожоги При острых отравлениях — нарушение дыхательных функций, ЦНС. При хронических отравления — нарушение функций печени и почек
Диоксид селена
Класс опасности — 1
ПДКсс — 0,05
ПДКмр — 0,1
Вещество оказывает разъедающее действие на глаза кожу и дыхательные пути. Вдыхание может вызвать отек легких (см. Примечания). Вещество может оказывать действие на глаза, приводя к аллергоподобной реакции век (красные глаза). Показано медицинское наблюдение.
Повторный или длительный контакт может вызвать сенсибилизацию кожи. Вещество может оказывать действие на дыхательные пути и желудочно-кишечный тракт, центральную нервную систему и печень, приводя к раздражению носоглотки, желудочно-кишечному дистрессу и постоянный запах чеснока и поражению печени.
Сероводород
Класс опасности — 2
ПДКмр — 0,008
Бесцветный газ с запахом тухлых яиц.
Вещество раздражает глаза и дыхательные пути. Вдыхание газа может вызвать отек легких Быстрое испарение жидкости может вызвать обморожение. Вещество может оказывать действие на центральную нервную систему. Воздействие может вызвать потерю сознания. Воздействие может вызвать смерть. Эффекты могут быть отсроченными.
Бромбензол C6H5Br.
Класс опасности — 2
ПДКсс — 0,03
Вещество раздражает кожу. Проглатывание жидкости может вызвать аспирацию в легких с риском возникновения химического воспаления легких. Вещество может оказывать действие на нервную систему
Может оказывать действие на печень и почки, приводя к функциональным нарушениям
Метилмеркаптан Ch4SH
Класс опасности — 2
ПДКмр — 0,0001
Бесцветный газ с характерным запахом.
Газ тяжелее воздуха. и может стелиться по земле; возможно возгорание на расстоянии.
Вещество раздражает глаза, кожу и дыхательные пути. Вдыхание газа может вызвать отек легких. Быстрое испарение жидкости может вызвать обморожение. Вещество может оказывать действие на центральную нервную систему, приводя к дыхательную недостаточность. Воздействие в большой дозе может вызвать смерть.
За счёт сильного неприятного запаха метилмеркаптан используются для добавления во вредные газы, не имеющие запаха, для обнаружения утечки.
Нитробензол
Класс опасности — 4
ПДКсс — 0,004
ПДКмр — 0,2
Вещество может оказывать действие на кровяные клетки , приводя к образованию метгемоглобина. Воздействие может вызвать помутнение сознания. Эффекты могут быть отсроченными.
При длительном воздействии может оказывать действие на органы кроветворения и на печень.
Аммиак
Аммиак Nh4, нитрид водорода (запах нашатырного спирта), почти вдвое легче воздуха
Класс опасности — 2
ПДКсс — 0,004
ПДКмр — 0,2
Бесцветный газ с резким удушливым запахом и едким вкусом.
Ядовит, сильно раздражает слизистые оболочки.
При остром отравлении аммиаком поражаются глаза и дыхательные пути, при высоких концентрациях возможен смертельный исход. Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями. При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
Смесь аммиака с воздухом взрывоопасна.
Загрязняющие вещества 4 класса опасности — Челябинский гидрометеоцентр
Главная> Мониторинг среды> Загрязняющие вещества> Загрязняющие вещества 4 класса опасностиОксид углерода (угарный газ).
Оксид углерода – бесцветный газ, не имеющий запаха, немного легче воздуха, плохо растворим в воде, имеет температуру кипения: – 191,5°С. На воздухе загорается при температуре 700°С и сгорает синим пламенем до СО2.
Источники поступления в окружающую среду.
Монооксид углерода входит в состав атмосферы (10%). В атмосферу оксид углерода попадает в составе вулканических и болотных газов, в результате лесных и степных пожаров, выделения микроорганизмами, растениями, животными и человеком. Из поверхностных слоев океанов в год выделяется 220х106 тонн оксида углерода в результате фоторазложения красных, сине-зеленых и др. водорослей, продуктов жизнедеятельности планктона. Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
Угарный газ попадает в атмосферу от промышленных предприятий, в первую очередь металлургии. В металлургических процессах при выплавке 1 млн. тонн стали образуется 320-400 тонн оксида углерода. Большое количество СО образуется в нефтяной промышленности и на химических предприятиях (крекинг нефти, производство формалина, углеводородов, аммиака и др.). Еще одним немаловажным источником оксида углерода является табачный дым. Высока концентрация оксида углерода в угольных шахтах, на углеподающих трассах. Оксид углерода образуется при неполном сгорании топлива в печах и двигателях внутреннего сгорания. Важным источником оксида углерода является автомобильный транспорт.
В результате деятельности человека в атмосферу ежегодно поступает 350-600х106 тонн угарного газа. Около 56-62% этого количества приходится на долю автотранспорта (содержание оксида углерода в выхлопных газах может достигать величины 12%).
Поведение в окружающей среде.
При обычных условиях монооксид углерода инертен. Он химически не взаимодействует с водой. Растворимость СО в воде около 1:40 по объему. В растворе способен восстанавливать соли золота и платины до свободных металлов уже при обычной температуре. Не реагирует СО также с щелочами и кислотами. Взаимодействует с едкими щелочами только при повышенных температурах и высоких давлениях.
Убыль оксида углерода в окружающей среде происходит за счет его разложения почвенными грибами. Кроме того, при избытке кислорода в почвах тяжелого механического состава, богатых органическими веществами, имеет место переход СО в СО2.
Воздействие на организм человека.
Оксид углерода чрезвычайно ядовит. Допустимое содержание СО в производственных помещениях составляет 20 мг/м3 в течение рабочего дня, 50 мг/м3 в течение 1 часа, 100 мг/м3 в течение 30 минут, в атмосферном воздухе города максимальная разовая (за 20 мин) – 5 мг/м3, среднесуточная ПДК – 3 мг/м3. Естественный уровень содержания оксида углерода в атмосферном воздухе – 0,01-0,9 мг/м3.
СО вдыхается вместе с воздухом и поступает в кровь, где конкурирует с кислородом за молекулы гемоглобина. Оксид углерода, имея двойную химическую связь, соединяется с гемоглобином более прочно, чем молекула кислорода. Чем больше СО содержится в воздухе, тем больше молекул гемоглобина связывается с ним и тем меньше кислорода достигает клеток организма. Нарушается способность крови доставлять кислород к тканям, вызываются спазмы сосудов, снижается иммунологическая активность человека, сопровождающиеся головной болью, потерей сознания и смертью. По этим причинам СО в повышенных концентрациях представляет собой смертельный яд.
СО нарушает фосфорный обмен. Нарушение азотистого обмена вызывает зотемию, изменение содержания белков плазмы, снижение активности холинэстеразы крови и уровня витамина В6. Угарный газ влияет на углеводный обмен, усиливает распад гликогена в печени, нарушая утилизацию глюкозы, повышая уровень сахара в крови. Поступление СО из легких в кровь обусловлено концентрацией СО во вдыхаемом воздухе и длительностью ингаляции. Выделение СО происходит главным образом через дыхательные пути.
Больше всего при отравлении страдает ЦНС. При вдыхании небольшой концентрации (до 1 мг/л) – тяжесть и ощущение сдавливания головы, сильная боль во лбу и висках, головокружение, дрожь, жажда, учащение пульса, тошнота, рвота, повышение температуры тела до 38-40°С. Слабость в ногах свидетельствует о распространении действия на спинной мозг.
Чрезвычайная ядовитость СО, отсутствие у него цвета и запаха, а также очень слабое поглощение его активированным углем обычного противогаза делают этот газ особенно опасным.
Класс опасности вещества — 4.
Аммиак.
Аммиак – бесцветный газ с резким запахом, температура плавления – 80°С, температура кипения – 36°С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Нахождение в природе.
В природе образуется при разложении азотсодержащих органических соединений.
Резкий запах аммиака известен человеку с доисторических времен, так как этот газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.
Антропогенные источники поступления в окружающую среду.
Основными источниками выделения аммиака являются азотнотуковые комбинаты, предприятия по производству азотной кислоты и солей аммония, холодильные установки, коксохимические заводы и животноводческие фермы. В районах техногенного загрязнения концентрации аммиака достигают величин 0,015-0,057 мг/м3, в контрольных районах – 0,003-0,005 мг/м3.
Влияние на организм человека.
Этот газ токсичен. Человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации – 0,0005 мг/л, когда еще нет большой опасности для здоровья. При повышении концентрации в 100 раз (до 0,05 мг/л) проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей, возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей и становятся опасными для жизни. Внешние признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, резко снижается слуховой порог: даже не слишком громкие звуки становятся невыносимы и могут вызвать судороги. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми – до снижения интеллекта и изменения личности. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо тщательно соблюдать меры предосторожности.
Хроническое воздействие сублетальных доз аммиака приводит к вегетативным расстройствам, повышению возбудимости парасимпатического отдела нервной системы, жалобы на слабость, недомогание, насморк, кашель, боли в груди.
Класс опасности вещества – 4.
«назад»
СПб | ПДК загрязняющих веществ в атмосферном воздухе
ПДК загрязняющих веществ в атмосферном воздухе
В городах воздух очень сильно загрязняют вредные выбросы автотранспорта и промышленных предприятий, выбрасывающих целую гамму веществ, каждое из которых с разной степенью интенсивности отрицательно влияет на здоровье человека.
Для всех, загрязняющих веществ существуют нормы ПДК (предельно допустимых концентраций) веществ в воздухе. За соблюдением этих норм должны следить специальные органы (в Москве это ГПУ «Мосэкомониторинг» ) и в случае систематического их нарушения накладывать определенные санкции: от штрафа до закрытия предприятия.
На данной странице приведены краткие характеристики некоторых наиболее распространенных вредных веществ, выбрасываемых в воздух автотранспортом и промышленными предприятиями.
Класс опасности вредных веществ — условная величина, предназначенная для упрощённой классификации потенциально опасных веществ.
Стандарт ГОСТ 12.1.007-76 «Классификация вредных веществ и общие требования безопасности» устанавливает следующие признаки для определения класса опасности вредных веществ:
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности:
I вещества чрезвычайно опасные
II вещества высокоопасные
III вещества умеренно опасные
IV вещества малоопасные
ПДК — предельная допустимая концентрация загрязняющего вещества в атмосферном воздухе – концентрация, не оказывающая в течение всей жизни прямого или косвенного неблагоприятного действия на настоящее или будущее поколение, не снижающая работоспособности человека, не ухудшающая его самочувствия и санитарно-бытовых условий жизни.
ПДКсс – предельно допустимая среднесуточная концентрация химического вещества в воздухе населенных мест, мг/м3. Эта концентрация не должна оказывать на человека прямого или косвенного вредного воздействия при неопределенно долгом (годы) вдыхании.
Характеристики вредных веществ.
Сернистый ангидрид (диоксид серы) SO2
Класс опасности — 3
ПДКсс — 0,05
ПДКмр — 0,5
Бесцветный газ с характерным резким запахом. Токсичен.
В лёгких случаях отравления сернистым ангидридом появляются кашель, насморк, слезотечение, чувство сухости в горле, осиплость, боль в груди; при острых отравлениях средней тяжести, кроме того, головная боль, головокружение, общая слабость, боль в подложечной области; при осмотре — признаки химического ожога слизистых оболочек дыхательных путей.
Длительное воздействие сернистого ангидрида может вызвать хроническое отравление. Оно проявляется атрофическим Ринитом, поражением зубов, часто обостряющимся токсическим бронхитом с приступами удушья. Возможны поражение печени, системы крови, развитие пневмосклероза.
Особенно высокая чувствительность к диоксиду серы наблюдается у людей с хроническими нарушениями органов дыхания, с астмой.
Диоксид серы образуется при использовании резервных видов топлива предприятиями теплоэнергетического комплекса (мазут, уголь, газ низкого качества) и выбросов дизельного автотранспорта.
Азота оксид (окись азота) NO.
Класс опасности -2
ПДКсс — 0,4
ПДКмр — 0,06
Бесцветный газ со слабым сладковатым запахом, известен под названием «веселящий газ», т.к. значительные количества его возбуждающе действуют на нервную систему. В смеси с кислородом применяют для наркоза в легких операциях.
Соединение обладает положительным биологическим действием. NO является важнейшим биологическим проводником, способным вызывать на клеточном уровне большое количество позитивных изменений, что приводит к улучшению кровообращения, иммунной и нервной систем.
Оксид азота образуется при горении угля, нефти и газа. Он образуется при взаимодействии азота N2 и кислорода O2 при высокой температуре: чем выше температура горения угля, нефти и газа, тем больше образуется оксида азота. Далее при обычной температуре NO окисляется до NO2, который уже является вредным веществом.
Азота диоксид (двуоокись азота) NO2
Класс опасности — 2
ПДКсс — 0,004
ПДКмр — 0,085
При высоких концентрациях бурый газ с удушливым запахом. Действует как острый раздражитель. Однако при тех концентрациях, которые присутствуют в атмосфере, NO2 является скорее потенциальным раздражителем и только потенциально его можно сравнивать с хроническими легочными заболеваниями. Однако у детей в возрасте 2 -3 года наблюдался некоторый рост заболеваний бронхитом.
Под воздействием солнечной радиации и при наличии несгоревших углеводородов окислы азота вступают в реакции с образованием фотохимического смога.
Часто различные окислы азота, которые образуются при сгорании любых видов топлива, объединяют в одну группу «NOx». Однако наибольшую опасность представляет именно двуокись азота NO2
Углерода окись СО (угарный газ)
Класс опасности — 4
ПДКсс — 0,05
ПДКмр — 0,15
Газ без цвета и запаха. Токсичен. При острых отравлениях головная боль, головокружение, тошнота, слабость, одышка, учащенный пульс. Возможна потеря сознания, судороги, кома, нарушение кровообращения и дыхания. При хронических отравлениях появляются головная боль, бессонница, возникает эмоциональная неустойчивость, ухудшаются внимание и память. Возможны органические поражения нервной системы, сосудистые спазмы. Углерода окись образуется в результате неполного сгорания углерода в топливе. В частности при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода. Подобное образование происходит в печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть, отсюда и одно из названий — «угарный газ».
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания автомобилей. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха.
Углерода двуокись (углекислый газ) СО2
Бесцветный газ со слабым кисловатым запахом. Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье. Вызывает гипоксию (длительностью до нескольких суток), головные боли, головокружение, тошноту (конц. 1.5 — 3%). При концентрации выше 61% теряется работоспособность, появляется сонливость, ослабление дыхания, сердечной деятельности, возникает опасность для жизни. СО2 поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления.
Ванадия пятиокись V2O5.
Класс опасности — 1
ПДКсс — 0,002
Ядовита. Вызывает раздражение дыхательных путей, легочные кровотечения, головокружение, нарушение деятельности сердца, почек и т.д. Канцероген. Соединение образуется в небольших количествах при сжигании мазута.
Сероуглерод (дисульфид углерода) CS2, бесцветная жидкость с неприятным запахом.
Класс опасности — 2
ПДКсс — 0,005
ПДКмр — 0,03
Пары сероуглерода ядовиты и очень легко воспламеняются. Действует на центральную и переферическую нервные системы, сосуды, обменные процессы.
При легких отравлениях — наркотическое действие, головокружение. При отравлении средней тяжести возникает возбуждение с возможным переходом в кому. При хроничнской интоксикации возникают нервно сосудистые растройства, нарушение психики, сна и т.д.
При длительных отравлениях могут возникать энцефалиты и полиневриты. Могут наблюдаться рецидивы судорог с потерей сознания, угнетение дыхания. При приеме внутрь наступают тошнота, рвота, боли в животе. При контакте с кожей наблюдаются гиперемия и химические ожоги.
Ксилол (диметилбензол)
Класс опасности — 3
ПДКсс — 0,2
ПДКмр — 0,2
Образует взрывоопасные паровоздушные смеси. Вызывает острые и хронические поражения кроветворных органов, дистрофические изменения в печени и почках, при контактах с кожей — дерматиты.
Бензол
Класс опасности — 2
ПДКсс — 0,1
ПДКмр — 1,5
Бесцветная летучая жидкость со своеобразным нерезким запахом.
Канцероген.При острых отравлениях наблюдается головная боль, головокружение, тошнота, рвота, возбуждение сменяющееся угнетенным состоянием, частый пульс, падение кровяного давления. В тяжелых случаях — судороги, потеря сознания. Хронические отравления проявляются изменением крови (нарушение функции костного мозга), головокружением, общей слабостью, расстройством сна, быстрой утомляемостью. У женщин — нарушение менструальной функции.
Бензпирен, бенз(а)пирен
Класс опасности — 1
ПДКсс — 0,01
Образуется при сгорании углеводородного жидкого, твёрдого и газообразного топлива (в меньшей степени при сгорании газообразного).Может появиться в дымовых газах при сжигании любого топлива с недостатком кислорода в отдельных зонах горения. Бенз(а)пирен является наиболее типичным химическим канцерогеном окружающей среды, он опасен для человека даже при малой концентрации, поскольку обладает свойством биоаккумуляции. Будучи химически сравнительно устойчивым, бенз(а)пирен может долго мигрировать из одних объектов в другие. В результате многие объекты и процессы окружающей среды, сами не обладающие способностью синтезировать бенз(а)пирен, становятся его вторичными источниками. Бенз(а)пирен оказывает также мутагенное действие.
Толуол (метилбензол)
Класс опасности — 3
ПДКсс — 0,6
ПДКмр — 0,06
Бесцветная горючая жидкость.
Пределы взрываемой смеси с воздухом 1.3 — 7%.
Толуол (метилбензол) — является сильно токсичным ядом, влияющим на функцию кроветворения организма, также, как и его предшественник, бензол. Нарушение кроветворения проявляется в цианозе, гипоксии. Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое.
Хлор
Класс опасности — 2
ПДКсс — 0,03
ПДКмр — 0,1
Желто-зеленый газ с резким раздражающим запахом. Раздражает слизистые оболочки глаз и дыхательных путей. К первичным воспалительным процессам обычно присоединяется вторичная инфекция. Острые отравления развиваются почти немедленно. При вдыхании средних и низких концентраций отмечаются стеснение и боль в груди, учащенное дыхание, резь в глазах, слезотечение, повышенное содержание лейкоцитов в крови, температуры тела и т.п. Возможны бронхопневмония, отек легких, депрессивное состояние, судороги. Как отдаленные последствия наблюдаются катары верхних дыхательных путей, бронхит, пневмосклероз и др. Возможна активизация туберкулеза. При длительном вдыхании небольших концентраций наблюдаются аналогичные, но медленно развивающиеся формы заболевания.
Хром шестивалентный
Класс опасности — 1
ПДКсс — 0,0015
ПДКмр — 0,0015
Токсичен. Начальные формы заболевания проявляются ощущением сухости и болью в носу, першением в горле, затруднением дыхания, кашлем и т.д. При длительном контакте развиваются признаки хронического отравления: головная боль, слабость, диспепсия, потеря в весе и др. Нарушаются функции желудка, печени и поджелудочной железы. Возможны бронхит, астма, диффузный пневмосклероз. При воздействии на кожу могут развиваться дерматиты, экземы.
Соединения хрома обладают канцерогенным действием.
Сажа
Класс опасности — 3
ПДКсс — 0,5
ПДКмр — 0,15
Дисперсный углеродный продукт неполного сгорания. Сажевые частицы не взаимодействуют с кислородом воздуха и поэтому удаляются только за счет коагуляции и осаждения, которые идут очень медленно. Поэтому, для сохранения чистоты окружающей среды нужен очень жесткий контроль за выбросами сажи.
Канцеpоген, способствует возникновению pака кожи.
Озон (О3)
Класс опасности — 1
ПДКсс — 0,003
ПДКмр — 0,16
Взрывчатый газ синего цвета с резким характерным запахом. Убивает микроорганизмы, поэтому его применяют для очистки воды и воздуха (озонирование). Однако в воздухе допустимы лишь очень малые концентрации, т.к. озон чрезвычайно ядовит (более чем угарный газ СО).
Свинец и его соединения (кроме тетраэтилсвинца)
Класс опасности — 1
ПДКсс — 0,0003
Ядовит, воздействует на центpальную неpвную систему, даже малые дозы свинца вызывают у детей отставание в pазвитии интеллекта. Поражение нервной системы проявляется астенией, при выраженных формах — энцефалопатией, параличами (преимущественно разгибателей кистей и пальцев рук), полиневризмом. При хронической интоксикации возможны поражения печени, сердечно-сосудистой системы, нарушение эндокринных функций (например, у женщин — выкидыши). Угнетение иммуннобиологической реактивности способствует повышенной общей заболеваемости. Возможны и смеpтельные отpавления. Свинец влияет на нервную систему человека, что приводит к снижению
интеллекта, вызывает изменение физической активности, координации слуха, воздействует на сердечно-сосудистую систему, приводя к заболеванию сердца. Это оказывает негативное влияние на состояние здоровья населения и в первую очередь детей, которые наиболее восприимчивы к свинцовым отравлениям.
Канцероген, мутаген.
Тетроэтилсвинец
ОБУВ — 0,000003
Горюч.
При температуре выше 77°C могут образоваться взрывоопасныe смеси пар/воздух.
Вещество раздражает глаза, кожу, дыхательные пути. Вещество может оказывать действие на центральную нервную систему, приводя к раздражительности, бессоннице, сердечным расстройствам. Воздействие может вызывать помутнение сознания. Воздействие высоких концентраций может вызвать смерть. Показано медицинское наблюдение. При долговременном или многократном воздействии может оказать токсическое действие на репродуктивную функцию человека.
Формальдегид HCOH
Бесцветный газ с резким запахом.
Токсичен, оказывает отрицательное влияние на генетику, органы дыхания, зрения и кожный покров. Оказывает сильное воздействие на нервную систему. Формальдегид занесен в список канцерогенных веществ. Вещество может оказывать действие на печень и почки, приводя к функциональным нарушениям. Применяют формальдегид при изготовлении пластмасс, а основная часть формальдегида идет на изготовление ДСП и других древесностружечных материалов. В них феноло-формальдегидная смола составляет 6-18% от массы стружек.
Фенол
Фенол – летучее вещество с характерным резким запахом. Пары его ядовиты. При попадании на кожу фенол вызывает болезненные ожоги. При острых отравлениях — нарушение дыхательных функций, ЦНС. При хронических отравлениях- нарушение функций печени и почек.
Диоксид селена
Класс опасности — 1
ПДКсс — 0,05
ПДКмр — 0,1
Вещество оказывает разъедающее действие на глаза кожу и дыхательные пути. Вдыхание может вызвать отек легких (см. Примечания). Вещество может оказывать действие на глаза, приводя к аллергоподобной реакции век (красные глаза). Показано медицинское наблюдение.
Повторный или длительный контакт может вызвать сенсибилизацию кожи. Вещество может оказывать действие на дыхательные пути и желудочно-кишечный тракт, центральную нервную систему и печень, приводя к раздражению носоглотки, желудочно-кишечному дистрессу и поражению печени.
Сероводород
Класс опасности — 2
ПДКмр — 0,008
Бесцветный газ с запахом тухлых яиц.
Вещество раздражает глаза и дыхательные пути. Вдыхание газа может вызвать отек легких Быстрое испарение жидкости может вызвать обморожение. Вещество может оказывать действие на центральную нервную систему. Воздействие может вызвать потерю сознания. Воздействие может вызвать смерть. Эффекты могут быть отсроченными.
Бромбензол C6H5Br.
Класс опасности — 2
ПДКсс — 0,03
Вещество раздражает кожу. Проглатывание жидкости может вызвать аспирацию в легких с риском возникновения химического воспаления легких. Вещество может оказывать действие на нервную систему.Может оказывать действие на печень и почки, приводя к функциональным нарушениям.
Метилмеркаптан Ch4SH
Класс опасности — 2
ПДКмр — 0,0001
Бесцветный газ с характерным запахом.
Газ тяжелее воздуха и может стелиться по земле; возможно возгорание на расстоянии.
Вещество раздражает глаза, кожу и дыхательные пути. Вдыхание газа может вызвать отек легких. Быстрое испарение жидкости может вызвать обморожение. Вещество может оказывать действие на центральную нервную систему, приводя к дыхательной недостаточности. Воздействие в большой дозе может вызвать смерть.За счёт сильного неприятного запаха метилмеркаптан используются для добавления во вредные газы, не имеющие запаха, для обнаружения утечки.
Нитробензол
Класс опасности — 4
ПДКсс — 0,004
ПДКмр — 0,2
Вещество может оказывать действие на кровяные клетки , приводя к образованию метгемоглобина. Воздействие может вызвать помутнение сознания. Эффекты могут быть отсроченными.
При длительном воздействии может оказывать действие на органы кроветворения и на печень.
Аммиак
Аммиак Nh4, нитрид водорода (запах нашатырного спирта), почти вдвое легче воздуха
Класс опасности — 2
ПДКсс — 0,004
ПДКмр — 0,2
Бесцветный газ с резким удушливым запахом и едким вкусом.
Ядовит, сильно раздражает слизистые оболочки.
При остром отравлении аммиаком поражаются глаза и дыхательные пути, при высоких концентрациях возможен смертельный исход. Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями. При хронических отравлениях наблюдаются расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.
Смесь аммиака с воздухом взрывоопасна.
нормы. Датчик угарного газа с сигнализацией
В настоящее время довольно часто фиксируется превышение ПДК угарного газа, приводящее к серьезным отравлениям. Причины в большом количестве отопительных систем, использовании твердотопливных котлов, иных устройств. Чтобы измерить ПДК угарного газа в воздухе рабочей зоны, целесообразно установить специальное оборудование.
Именно поэтому были созданы специальные приборы, позволяющие определять уровень опасного газа в помещениях.

Негативное влияние
CO — газ, который является продуктом процесса неполного горения разнообразных органических соединений. Он выделяется в минимальных количествах и в процессе приготовления пищи.
Превышение ПДК угарного газа вызывает тяжелые поражения органов и систем организма. В некоторых случаях возможен даже летальный исход. Многие люди погибают из-за того, что не могут ощутить угрозу до появления видимых симптомов отравления.
Так как этот газ без запаха, цвета, можно обнаружить его только при помощи специальных приборов. Он оказывает в момент вдыхания на организм токсичное действие. После попадания в легкие человека, газ смешивается с гемоглобином крови, при этом получается карбоксигемоглобин. Подобное вещество не пропускает к клеткам кислород, возникает гипоксия тканей человеческого организма. Нарушается функционирование внутренних органов,в частности головного мозга и нервной системы.
Степень отравления зависит от количества угарного газа внутри помещения. При показателе СО на уровне 0,08% сначала возникает незначительное недомогание и сонливость. Затем возникает головная боль, появляется головокружение, потом начинается кашель.
В самых сложных случаях появляется поражение слизистой оболочки носоглотки, нарушается работа сердца, бледнеет кожа. При увеличении уровня СО до 0,32 % в связи с кислородным голоданием человек теряет сознание, появляется паралич и кома, в течение 30 минут возникает смерть. При увеличении уровня газа до 1,2% смерть наступает спустя три минуты. Превышение ПДК угарного газа возможно при неисправной вентиляции, проблемах с дымоотводными каналами.
Уровень СО повышается также при выходе из строя бойлеров, газовых приборов. Газ и продукты его сгорания нельзя обнаружить без специального прибора. Чтобы спасти пострадавшего человека, важно незамедлительно его вынести на свежий воздух.

Оказание помощи
Необходимо проводить вентилирование легких при помощи кислородной маски. Среди причин, приводящих к превышению ПДК угарного газа, можно назвать неправильно устроенную систему отведения дыма. При эксплуатации отопительных элементов в частном секторе важно соблюдать правила техники безопасности.
Первая медицинская помощь при отравлении угарным газом предполагает проветривание помещения. Виски пострадавшего нужно протереть уксусом, дать ему раствор питьевой соды. Если человек находится в бессознательном состоянии, подносят ватку с нашатырным спиртом. Если пострадавший от вдыхания СО не приходит в себя, то ему необходимо сделать непрямой массаж сердца.

Особенности прибора
Чтобы определить присутствие опасного газа в воздухе, применяется специальный датчик CO. Этот небольшой прибор без ошибок может выявить количество угарного газа в анализируемом помещении. Используют его в разных местах:

Средства защиты
Для того чтобы не допустить возможной утечки, можно установить датчик угарного газа с сигнализацией. В случае возрастания уровня токсических испарений прибор сообщит о состоянии воздуха в комнате. Детектор сможет опознать не только угарный газ, но и предупредит об утечке бытового.
Датчик CO может устанавливаться на вертикальной поверхности. Индикация систематически сигнализирует о состоянии этого устройства, а также об уровне отравляющих газообразных веществ в воздухе помещения. У прибора мгновенная реакция на изменение химического состава воздуха. Производители не рекомендуют осуществлять монтаж сенсоров вблизи источников открытого огня.
Если в помещении есть сразу несколько агрегатов обогрева, важно организовать систему из такого же количества детекторов. Большое количество производителей ежегодно обеспечивает потребителей различными устройствами, предназначенными для определения отравляющего вещества.
Особенности действия
Детектор угарного газа функционирует на батарейках. Индивидуальной особенностью прибора является идентификация дыма. Профессионалы советуют монтировать подобное устройство отдельно от системы противопожарной безопасности.
Детектор угарного газа издает звуковой сигнал, если превышается допустимый показатель. До начала эксплуатации нужно познакомиться с инструкцией, протестировать новый прибор, не допуская чрезвычайных ситуаций для обычных людей.

Разновидности прибора
В настоящее время производители предлагают приборы портативного вида, ставшие обязательным атрибутом противопожарной безопасности в РФ. У любого из них есть специальный датчик угарного газа с сигнализацией, издающей отрывистые сигналы раз в минуту. Важно своевременно менять батарейку. Ведь от исправности прибора напрямую зависит здоровье и жизнь людей. Профессионалы рекомендуют менять их 1-2 раза в год.
Полезные советы
Если детектор постоянно издает звуки — это является сигналом повышенного содержания в воздухе токсинов. В таких ситуациях необходимо сразу обращаться в аварийную службу. Обнаружив симптомы отравления угарным газом, важно незамедлительно открыть в помещении окна, выйти из него, ждать спасателей на улице. Профессионалы оценят процентное содержание кислорода, выявят проблемные места. Если сигнал оказался ложным, и образование угарного газа соответствует нормам, детектор подлежит замене.
Часть бытовых датчиков для угарного газа может распознавать и летучие вещества, которые не опасны для человека. К примеру, это могут быть любые содержащие спирт жидкости. Чтобы не допустить срабатывания датчика, желательно тщательно проветривать помещение. При повышенной концентрации паров спирта, система подает ложный сигнал тревоги. В таком случае нужно переместить прибор подальше от места создания кулинарных шедевров.
Варианты анализаторов воздуха
Выделяют три вида устройств:
инфракрасные датчики;
на основе полупроводников;
с электрохимическим методом определения.
Устройства полупроводникового типа функционируют на базе химических процессов, которые протекают между атомами. В основном активным веществом выступают диоксиды: олова, углерода, рутения.
Полупроводниковые системы подключают к системе электрического снабжения. Они в основном предназначаются для применения в транспорте. Токсины определяются при росте проводимости пораженного воздуха, что происходит из-за контакта компонентов используемого детектора. Затем срабатывает механизм, который сигнализирует о превышении концентрации отравляющего газа в воздухе. Происходит взаимодействие между атомами диоксида рутения либо диоксида олова. Чтобы проходила диффузия, химические элементы должны подвергаться нагреву до 250 градусов по Цельсию.

Работа с химической точки зрения
Так как проводимость чистого воздуха на основе этих оксидов минимальна, прибор активен только при существенных количествах угарного газа в воздухе помещения. Нагревание приводит к окислительно-восстановительной реакции, в которой СО выступает восстановителем, результатом является увеличение проводимости капсулы детектора, замыкание контактов датчика, срабатывание тревоги.
Такой прибор позволяет вести контроль ПДК угарного газа в автосервисе, жилом помещении, в производственных цехах. Напряжение определяется количеством монооксида углерода (угарного газа) в воздухе. Если превышается его допустимый уровень, происходит рост напряжения, в результате чего полупроводниковый детектор срабатывает.
Ложные срабатывания возможны только в тех ситуациях, когда устройство находится вблизи очага возгорания или открытого огня. Именно поэтому профессионалы советуют устанавливать подобные устройства на определенном расстоянии от нагревательной панели.
В конструкции полупроводникового датчика предусмотрено твердое основание. Оно изготовлено из полимерного материала, который относится к классу насыщенных полиэфиров. Корпус изготовлен из нержавеющей стали.
Фронтальная часть выполняет функцию впускного отверстия, в который попадает воздух, загрязненный токсинами. Чтобы избежать попадания иных веществ горения, в корпусе детектора есть специальная угольная прослойка, являющаяся абсорбентом. Двойной слой нержавеющей сетки позволяет защищать прибор от разнообразных внешних загрязнителей, к примеру, от пыли.
Под слоем угольного фильтра располагается чувствительный элемент. Напряжение подводится только к металлическим клеммам, находящимся с другой стороны капсулы. Полупроводниковые приборы имеют 3 контакта, предназначенные для подключения электрического тока. В подобных устройствах есть 2 электрических контура: для элемента из оксида металла, для самого нагревателя.
Такой сенсор имеет высокую степень износостойкости, отличается продолжительным эксплуатационным периодом. Небольшие размеры способствуют минимальной трате электроэнергии на его обслуживание, поэтому полупроводниковые датчики считают самыми эффективными устройствами для выявления концентрации угарного газа в производственных цехах и помещениях бытового предназначения.
Инфракрасные варианты приборов
В таких устройствах в качестве анализатора применяется воздух, проверяемый потом на присутствие в нем угарного газа путем инфракрасного облучения. Основным критерием, который определяет уровень СО, считается волновой спектр ИК-элемента, поглощающий молекулы токсинов угарного газа. Так как чувствительность света к внешнему воздействию высока, датчики могут идентифицировать разнообразные загрязнители, включая и метан.
При настройке ИК-сенсора используется эталонный показатель. Например, нормы ПДК по угарному газу для котельных регламентированы ГОСТом 12.2.007.0-75. При достижении концентрации СО порядка 20 ± 5 мг/м3 срабатывает звуковой прерывистый сигнал. Если же количественный показатель СО достигает диапазона 100 ± 25 мг/м3, то в таком случае включается звуковой и световой сигналы.
Все газоанализаторы, применяемые в производственных цехах, должны иметь сертификат соответствия ГОСТа. Владелец также должен иметь разрешение на применение их в данных помещениях от Госгортехнадзора РФ. В автоматизированных котельных датчики должны быть установлены у входа в помещение. На площади в 200 м2 предполагается установка 1 датчика дополнительно к прибору контроля СО. Ежегодно проверка работоспособности прибора осуществляется в специальных центрах стандартизации и метрологии.
В качестве чувствительного элемента в инфракрасных газоанализаторах выступает нить накаливания или светодиод. Подобный ИК-датчик называют недисперсионным. Анализ уровня газа осуществляется при помощи специальных светофильтров, настроенных на восприятие определенного спектра.
Среди недостатков таких приборов — высокая стоимость, поэтому они применяются далеко не во всех производственных помещениях в РФ. Анализ превышения ПДК угарного газа в воздухе (мг/м3) такими приборами проводится в нашей стране только в крупных учреждениях. При изменении химического состава воздуха происходит реакция чувствительного элемента, изменяется световая волна, детектором фиксируется повышение допустимых норм угарного газа (иных вредных соединений). Между процентным содержанием химикатов в воздухе и изменением спектра существует прямая зависимость. Благодаря селективности такого оборудования удается сканировать атмосферный воздух на присутствие тяжелых газообразных соединений (хлора и аммиака).
Для питания прибора требуется подключение его по локальной сети к напряжению 220 В. Отметим, что в настоящее время производители предлагают и такие модификации, которые функционируют на основе батареек.
На приборе есть специальный дисплей с подсветкой, а также установлен звуковой сигнал тревоги. При обнаружении серьезных утечек угарного газа происходит мгновенное срабатывание сенсора, устройство издает отрывистый четкий писк, монитор прибора мигает.

Каталитические детекторы СО
Основным их отличием является незначительное потребление электрической энергии в процессе непосредственной эксплуатации. Это объясняется отсутствием в приборе нагревательного элемента. Ведь в роли чувствительного вещества выступает жидкий электролит. Вполне можно эксплуатировать такие газоанализаторы без стационарной электрической сети, ограничившись аккумуляторными батарейками.
Суть сенсора в том, что проводится анализ содержания СО в воздухе посредством химической реакции окисления, протекающей внутри капсулы прибора. Чаще всего средой для электрохимического взаимодействия выступает гальваническая ячейка, которая наполнена раствором щелочи (гидроксида калия).
Некоторые производители предпочитают брать в качестве электролита растворы кислот, повышая стойкость ячейки к воздействию иных молекул, улучшая ее эксплуатационные характеристики. При соприкосновении молекул угарного газа с электродом такого устройства, протекает химическое взаимодействие. Электролит отмечает уровень появившегося напряжения, преобразует этот показатель в процентное содержание СО.
В приборе есть микросхема, в которой зафиксирован ПДК угарного газа в помещении. Если норма превышается, в таком случае датчик дает сигнал о возникшей опасности. Небольшой компьютер, установленный в корпусе, следит с высокой вероятностью за скачками напряжения, появляющимися в результате протекания химической реакции.
Чтобы контролировать чистоты рабочей среды, производители, помимо полупроводниковых сенсоров, также используют угольные фильтры, способные удерживать «лишние» молекулы, не позволяя им взаимодействовать с угарным газом. Система химической защиты обеспечивает эффективность работы такого устройства, снижая вероятность появления ложной тревоги.
Подведем итоги
В любом производственном помещении, в котельной, гараже, в образовательных и медицинских учреждениях должны быть установлены газоанализаторы. Такие приборы, независимо от специфики внутреннего устройства (вида и типа) способны реагировать на повышение концентрации угарного газа в помещении, то есть помогают предотвращать серьезные трагедии.
Выхлопные газы — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 июля 2016; проверки требуют 15 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 июля 2016; проверки требуют 15 правок. Дым из выхлопных труб дизельного грузовика в момент запуска двигателя
Дым из выхлопных труб дизельного грузовика в момент запуска двигателяВыхлопны́е га́зы (отходящие газы) — отработавшее в двигателе рабочее тело. Являются продуктами окисления и неполного сгорания углеводородного топлива. Выбросы выхлопных газов — основная причина превышения допустимых концентраций токсичных веществ и канцерогенов в атмосфере крупных городов, образования смогов, являющихся частой причиной отравления в замкнутых пространствах.
Количество выделяемых в атмосферу автомобилями загрязняющих веществ определяется массовым выбросом газов и составом отходящих газов.
Количество отходящих газов автомобилей[править | править код]
В основном определяется массовым расходом топлива автомобилями. Расход по расстоянию нормируется и обычно указывается производителями (одна из потребительских характеристик). В отношении суммарного объема выходящих из глушителя выхлопных газов приблизительно можно ориентироваться на такую цифру — один килограмм сжигаемого бензина приводит к образованию примерно 16 килограммов смеси различных газов.
| ВАЗ 2110 1,5k литра | ВАЗ 2110 1,5i литра | Mitsubishi Colt 5-D 1.1i литра | ВАЗ 11113 0,75k литра | ВАЗ 21055 1,5D литра | |
| Расход в «городском» режиме, л/100км | 9,1 | 8,6 | 7,0 | 6,4 | 5,7 |
| Расход, равномерно 60 км/ч, л/100км | 6,5 | 6,5 | 3,7 | 3,2 | 3,8 |
- k — карбюраторный двигатель
- i — инжекторный двигатель
- D — дизельный двигатель
- плотность бензина при +20С колеблется от 0,69 до 0,81 г/см³
- плотность дизельного топлива при +20С по ГОСТ 305-82 не более 0,86 г/см³
Состав автомобильных выхлопных газов[править | править код]
| Бензиновые двигатели | Дизели | |
| N2, об.% | 74—77 | 76—78 |
| O2, об.% | 0,3—8,0 | 2,0—18,0 |
| H2O (пары), об.% | 3,0—5,5 | 0,5—4,0 |
| CO2, об.% | 0,0—16,0 | 1,0—10,0 |
| CO*, об.% | 0,1—5,0 | 0,01—0,5 |
| Оксиды азота*, об.% | 0,0—0,8 | 0,0002—0,5 |
| Углеводороды*, об.% | 0,2—3,0 | 0,09—0,5 |
| Альдегиды*, об.% | 0,0—0,2 | 0,001—0,009 |
| Сажа**, г/м3 | 0,0—0,04 | 0,01—1,10 |
| Бензпирен-3,4**, г/м3 | 10—20⋅10−6 | 10×10−6 |
* Токсичные компоненты
** Канцерогены
Влияние выхлопных газов на здоровье человека[править | править код]
 Выхлопная труба легкового автомобиля
Выхлопная труба легкового автомобиля  Загрязнение окружающей среды отработавшими газами и горюче-смазочными материалами локомотивных дизелей.
Загрязнение окружающей среды отработавшими газами и горюче-смазочными материалами локомотивных дизелей.Наибольшую опасность представляют оксиды азота, примерно в 10 раз более опасные, чем угарный газ, доля токсичности альдегидов относительно невелика и составляет 4—5 % от общей токсичности выхлопных газов. Токсичность различных углеводородов сильно отличается. Непредельные углеводороды в присутствии диоксида азота фотохимически окисляются, образуя ядовитые кислородсодержащие соединения — составляющие смога.
Обнаруженные в газах полициклические ароматические углеводороды — сильные канцерогены. Среди них наиболее изучен бензпирен, кроме него, обнаружены производные антрацена:
Кроме того, при использовании сернистых бензинов в отходящие газы могут входить оксиды серы, при применении этилированных бензинов — свинец (тетраэтилсвинец), бром, хлор, их соединения. Считается, что аэрозоли галоидных соединений свинца могут подвергаться каталитическим и фотохимическим превращениям, участвуя в образовании смога.
Длительный контакт со средой, отравленной выхлопными газами автомобилей, вызывает общее ослабление организма — иммунодефицит. Кроме того, газы сами по себе могут стать причиной различных заболеваний. Например, дыхательной недостаточности, гайморита, ларинготрахеита, бронхита, бронхопневмонии, рака лёгкого. Также выхлопные газы вызывают атеросклероз сосудов головного мозга. Опосредованно через легочную патологию могут возникнуть и различные нарушения сердечно-сосудистой системы. Также выхлопные газы повреждают ткани нервной системы и повышают риск развития деменции[1].
Отравления в замкнутом пространстве[править | править код]
Довольно часты случаи отравления выхлопными газами, в том числе с летальными исходами автомобилистов в гаражах, закрытых стоянках и внутри автомобилей (при утечке в салон), при плохой вентиляции. Также бывали случаи отравления выхлопными газами в квартирах домов, находящихся вблизи автостоянок (вдыхание выхлопных газов приводит к накоплению токсичных веществ в организме человека). Для борьбы с такими случаями вводятся строительные нормы вентиляции стоянок и сооружений, связанных с эксплуатацией и обслуживанием автомобилей.
Пути снижения выбросов и токсичности[править | править код]
Стимулом к сокращению объёмов предполагается заинтересованность в сокращении расхода топлива (крупная статья расходов в автомобильном транспорте).
- Колоссальное влияние на количество выбросов (не считая сжигания топлива и времени) играет организация движения автомобилей в городе (значительная часть выбросов происходит в «пробках» и перед светофорами[источник не указан 2715 дней]). При удачной организации возможно применение менее мощных двигателей, при невысоких (экономичных) промежуточных скоростях.
- Существенно снизить содержание углеводородов в отходящих газах, более чем в 2 раза, возможно применением в качестве топлива попутных нефтяных (пропан, бутан), или природного газов, при том, что главный недостаток природного газа — низкий запас хода, для города не столь значим.
- Кроме состава топлива, на токсичность влияет состояние и настройка двигателя (особенно дизельного — выбросы сажи могут увеличиваться до 20 раз и карбюраторного — до 1,5—2 раз изменяются выбросы оксидов азота).
- Значительно снижены выбросы (снижен расход топлива) в современных конструкциях двигателей с инжекторным питанием стабильной стехиометрической смесью неэтилированного бензина с установкой нейтрализатора, газовых двигателях, агрегатах с нагнетателями и охладителями воздуха, применением гибридного привода. Однако подобные конструкции сильно удорожают автомобили.
- Испытания SAE показали, что эффективный способ снижения выбросов окислов азота (до 90 %) и в целом токсичных газов — впрыск в камеру сгорания воды.
- Контролируется качественный состав изготавливаемого и реализуемого топлива (в России это стандарты на топливо, региональные требования, в Европе — нормативы ЕВРО).
- Предусмотрен контроль над состоянием и регулировками автомобилей. В России является обязанностью органов технического осмотра ГИБДД периодически контролировать доли оксидов углерода и углеводородов в выхлопе на двух частотах вращения, состояние предусмотренных систем нейтрализации на бензиновых двигателях (по ГОСТ Р 52033-2003), на газобаллонных (по ГОСТ Р 17.2.02.06-1999) и дымность на дизельных двигателях (по ГОСТ Р 52160-2003). Двухтактные двигатели не проходят никакую из этих проверок[источник не указан 1283 дня].
- В России вводятся повышенные ставки транспортного налога на мощность двигателя автомобиля.
- Топливо облагается специальными акцизами.
- Предусмотрены нормативы на выпускаемые автомобили. В России и европейских странах приняты стандарты ЕВРО, задающие как токсичность, так и количественные показатели, например:
- По Евро-3 выбросы: СН до 0,2 г/км, CO до 2,3 г/км и NOy до 0,15 г/км
- По Евро-4 выбросы: СН до 0,1 г/км, CO до 1,0 г/км и NOy до 0,08 г/км
- В некоторых регионах вводятся ограничения на движение большегрузного автотранспорта (например, в Москве).
химия, 8 класс :: SYL.ru
Все, что нас окружает, состоит из соединений различных химических элементов. Мы дышим не просто воздухом, а сложным органическим соединением, имеющим в своем составе кислород, азот, водород, двуокись углерода и другие необходимые составляющие. Влияние множества этих элементов на организм человека в частности и на жизнь на Земле в целом еще не изучено до конца. Для того чтобы понимать процессы взаимодействия элементов, газов, солей и других образований друг с другом, в школьный курс и был введен предмет «Химия». 8 класс – это старт уроков химии по утвержденной общеобразовательной программе.
Одним из самых распространенных соединений, содержащихся как в земной коре, так и в атмосфере, является оксид. Оксидом называется соединение любого химического элемента с атомом кислорода. Даже источник всего живого на Земле – вода, является оксидом водорода. Но в данной статье речь пойдет не об оксидах в общем, а об одном из самых часто встречаемых соединений – оксиде углерода. Данные соединения получаются путем слияния атомов кислорода и углерода. Эти соединения могут иметь в своем составе различные количества атомов углерода и кислорода, однако следует выделить два основных соединения углерода с кислородом: угарный газ и углекислый газ.
Химическая формула и способ получения угарного газа
Какова же его формула? Оксид углерода довольно легко запомнить – CO. Молекула угарного газа образуется тройной связью, в связи с чем обладает довольно высокой прочностью соединения и имеет очень небольшое межъядерное расстояние (0,1128 нм). Энергия разрыва данного химического соединения составляет 1076 кДж/Моль. Тройная связь возникает вследствие того, что элемент углерод имеет в своей структуре атома p-орбиталь, не занятую электронами. Это обстоятельство создает для атома углерода возможность стать акцептором электронной пары. А атом кислорода, наоборот, имеет на одной из p-орбиталей неразделенную пару электронов, а значит имеет электронно-донорные возможности. При соединении этих двух атомов кроме двух ковалентных связей появляется еще и третья – донорно-акцепторная ковалентная связь.
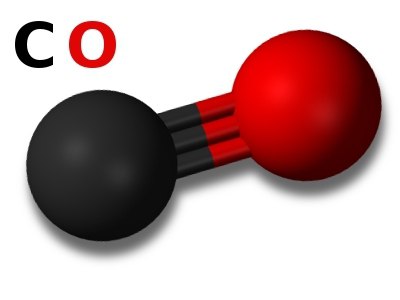
Существуют различные способы получения CO. Одним из самых простейших является пропускание углекислого газа над раскаленным углем. В лабораторных условиях угарный газ получают при помощи следующей реакции: муравьиную кислоту нагревают с серной кислотой, которая разделяет муравьиную кислоту на воду и угарный газ.
Также CO выделяется при нагревании щавелевой и серной кислоты.
Физические свойства CO
Оксид углерода (2) обладает следующими физическими свойствами – это бесцветный газ, не имеющий ярко выраженного запаха. Все посторонние запахи, появляющиеся при утечке угарного газа, являются продуктами распада органических примесей. Он намного легче воздуха, чрезвычайно токсичен, очень плохо растворяется в воде и отличается высокой степенью горючести.
Самое главное свойство CO – его отрицательное воздействие на организм человека. Отравление угарным газом может привести к летальному исходу. Более подробно о воздействии оксида углерода на организм человека будет рассказано ниже.
Химические свойства CO
Основные химические реакции, в которых могут применяться оксиды углерода (2) – это окислительно-восстановительная реакция, а также реакция присоединения. Окислительно-восстановительная реакция выражается в способности CO восстанавливать металл из оксидов при помощи их смешивания с дальнейшим нагреванием.
При взаимодействии с кислородом происходит образование углекислого газа с выделением значительного количества теплоты. Угарный газ горит синеватым пламенем. Очень важная функция оксида углерода – его взаимодействие с металлами. В результате подобных реакций образуются карбонилы металлов, подавляющее большинство которых являются кристаллическими веществами. Они применяются для изготовления сверхчистых металлов, а также для нанесения металлического покрытия. Кстати, карбонилы неплохо себя зарекомендовали в качестве катализаторов химических реакций.
Химическая формула и способ получения углекислого газа
Углекислый газ, или двуокись углерода, имеет химическую формулу CO2. Структура молекулы несколько отличается от структуры CO. В данном образовании углерод имеет степень окисления, равную +4. Структура молекулы линейная, а значит, неполярная. Молекула CO2 не обладает такой сильной прочностью, как CO. В земной атмосфере содержится около 0,03% углекислоты по общему объему. Увеличение этого показателя разрушает озоновый слой Земли. В науке это явление называется парниковым эффектом.
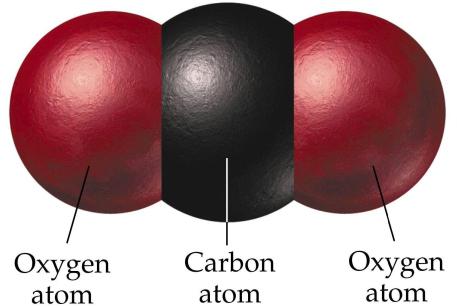
Получить углекислый газ можно различными путями. В промышленности он образуется в результате горения дымовых газов. Может быть побочным продуктом в процессе изготовления алкоголя. Его можно получить в процессе разложения воздуха на основные составляющие, такие как азот, кислород, аргон и другие. В лабораторных условиях оксид углерода (4) можно получить в процессе обжига известняка, а в домашних условиях добыть углекислый газ можно при помощи реакции лимонной кислоты и пищевой соды. Кстати, именно таким образом изготавливались газированные напитки в самом начале их производства.
Физические свойства CO2
 Углекислый газ представляет собой бесцветное газообразное вещество без характерного резкого запаха. Из-за высокого числа окисления данный газ обладает слегка кисловатым привкусом. Данный продукт не поддерживает процесс горения, так как сам является результатом горения. При повышенной концентрации углекислого газа человек утрачивает способность дышать, что приводит к летальному исходу. Более подробно о воздействии углекислого газа на организм человека будет рассказано далее. CO2 намного тяжелее воздуха и прекрасно растворяется в воде даже при комнатной температуре.
Углекислый газ представляет собой бесцветное газообразное вещество без характерного резкого запаха. Из-за высокого числа окисления данный газ обладает слегка кисловатым привкусом. Данный продукт не поддерживает процесс горения, так как сам является результатом горения. При повышенной концентрации углекислого газа человек утрачивает способность дышать, что приводит к летальному исходу. Более подробно о воздействии углекислого газа на организм человека будет рассказано далее. CO2 намного тяжелее воздуха и прекрасно растворяется в воде даже при комнатной температуре.Одним из самых интересных свойств углекислого газа является то, что у него нет жидкого агрегатного состояния при нормальном атмосферном давлении. Однако если воздействовать на структуру углекислого газа воздействие температурой в -56,6 °С и давлением около 519 кПа, то он трансформируется в бесцветную жидкость.
При существенном понижении температуры газ находится в состоянии так называемого «сухого льда» и испаряется при температуре выше чем -78 оС.
Химические свойства CO2
По своим химическим свойствам оксид углерода (4), формула которого CO2, является типичным кислотным оксидом и обладает всеми его свойствами.
1. При взаимодействии с водой образуется угольная кислота, обладающая слабой кислотностью и малой устойчивостью в растворах.
2. При взаимодействии с щелочами углекислый газ образует соответствующую соль и воду.
3. Во время взаимодействия с оксидами активного металла способствует образованию солей.
4. Не поддерживает процесс горения. Активировать данный процесс могут только некоторые активные металлы, такие как литий, калий, натрий.
Влияние угарного газа на организм человека
 Вернемся к основной проблеме всех газов – влиянию на организм человека. Угарный газ относится к группе крайне опасных для жизни газов. Для человека и животного он является чрезвычайно сильным ядовитым веществом, которое при попадании в организм серьезно поражает кровь, нервную систему организма и мышцы (в том числе и сердце).
Вернемся к основной проблеме всех газов – влиянию на организм человека. Угарный газ относится к группе крайне опасных для жизни газов. Для человека и животного он является чрезвычайно сильным ядовитым веществом, которое при попадании в организм серьезно поражает кровь, нервную систему организма и мышцы (в том числе и сердце).Оксид углерода в воздухе невозможно распознать, так как этот газ не имеет никакого ярко выраженного запаха. Именно этим он и опасен. Попадая через легкие в организм человека, угарный газ активизирует свою разрушительную деятельность в крови и в сотни раз быстрее кислорода начинает взаимодействовать с гемоглобином. В результате этого появляется очень стойкое соединение под названием карбоксигемоглобин. Оно препятствует доставке кислорода из легких к мышцам, что приводит к мышечному голоданию тканей. Особенно серьезно страдает от этого головной мозг.
Из-за отсутствия возможности распознать отравление угарным газом через обоняние, следует знать некоторые основные признаки, которые проявляются на ранних этапах:
- головокружение, сопровождающееся головной болью;
- шум в ушах и мерцание перед глазами;
- сильное сердцебиение и одышка;
- покраснение лица.
В дальнейшем у жертвы отравления появляется сильная слабость, иногда рвота. В тяжелых случаях отравления возможны непроизвольные судороги, сопровождающиеся дальнейшей потерей сознания и комой. Если же пациенту своевременно не будет оказана соответствующая медицинская помощь, то возможен летальный исход.
Влияние углекислого газа на организм человека
Оксиды углерода с кислотностью +4 относятся к разделу удушающих газов. Иными словами, углекислый газ не является токсичным веществом, однако может существенно влиять на приток кислорода к организму. При повышении уровня углекислого газа до 3-4% у человека возникает серьезная слабость, его начинает клонить в сон. При повышении уровня до 10% начинают развиваться сильнейшие головные боли, головокружение, ухудшение слуха, иногда наблюдается потеря сознания. Если концентрация углекислого газа поднимается до уровня 20%, то наступает смерть от кислородного голодания.
Лечение отравления углекислым газом очень простое – дать жертве доступ к чистому воздуху, при необходимости сделать искусственное дыхание. В крайнем случае нужно подключить пострадавшего к аппарату искусственной вентиляции легких.
Из описаний влияния двух данных оксидов углерода на организм мы можем сделать вывод, что большую опасность для человека все же представляет угарный газ с его высокой токсичностью и направленным воздействием на организм изнутри.
Углекислый газ не отличается таким коварством и менее вреден для человека, поэтому именно это вещество человек активно применяет даже в пищевой промышленности.
Применение оксидов углерода в промышленности и их влияние на различные аспекты жизни
Оксиды углерода имеют очень широкое применение в разных сферах деятельности человека, причем спектр их чрезвычайно богат. Так, окись углерода вовсю применяется в металлургии в процессе выплавки чугуна. Широкую популярность CO получил в качестве материала для хранения продуктов питания в охлажденном виде. Данный оксид применяют для обработки мяса и рыбы, чтобы придать им свежий вид и не изменить вкус. Важно не забывать про токсичность данного газа и помнить, что допустимая доза не должна превышать 200 мг на 1 кг продукта. CO в последнее время все чаще применяют в автомобильной промышленности в качестве топлива для автомобилей на газу.

Диоксид углерода нетоксичен, поэтому сфера его применения широко внедрена в пищевую промышленность, где его применяют в качестве консерванта или разрыхлителя. Также CO2 применяется при изготовлении минеральных и газированных вод. В твердом состоянии («сухой лед») он часто используется в морозильных установках для поддержания стабильно низкой температуры в помещении или приборе.
Большую популярность приобрели углекислотные огнетушители, пена из которых полностью изолирует огонь от кислорода и не дает пожару разгореться. Соответственно, еще одна сфера применения – пожарная безопасность. Баллоны в пневматических пистолетах также заряжены углекислотой. И конечно же, практически каждый из нас читал, из чего состоит освежитель воздуха для помещений. Да, одной из составляющих является углекислый газ.
Как видим, из-за своей минимальной токсичности углекислый газ больше и чаще встречается в повседневной жизни человека, тогда как угарный газ нашел применение в тяжелой промышленности.
Существуют и другие углеродные соединения с кислородом, благо формула углерода и кислорода позволяет применять различные варианты соединений с разным количеством атомов углерода и кислорода. Ряд оксидов может разниться от C2O2 до C32O8. И чтобы описать каждый из них, потребуется не одна страница.
Оксиды углерода в природе
Оба вида рассматриваемых здесь оксидов углерода так или иначе присутствуют в природном мире. Так, угарный газ может быть продуктом сгорания лесов или результатом жизнедеятельности человека (выхлопные газы и вредные отходы промышленных предприятий).
Уже известный нам диоксид углерода также является частью сложного состава воздуха. Его содержание в нем составляет около 0,03 % от всего объема. При увеличении этого показателя возникает так называемый «парниковый эффект», которого так опасаются современные ученые.
 Углекислый газ выделяют животные и человек путем выдыхания. Он является основным источником такого полезного для растений элемента, как углерод, поэтому многие ученые и бьют на сполох, указывая на недопустимость масштабных вырубок леса. Если растения перестанут поглощать углекислый газ, то процент его содержания в воздухе может повыситься до критических для человеческой жизнедеятельности показателей.
Углекислый газ выделяют животные и человек путем выдыхания. Он является основным источником такого полезного для растений элемента, как углерод, поэтому многие ученые и бьют на сполох, указывая на недопустимость масштабных вырубок леса. Если растения перестанут поглощать углекислый газ, то процент его содержания в воздухе может повыситься до критических для человеческой жизнедеятельности показателей.Видимо, многие власть держащие забыли пройденный в детстве материал учебника «Общая химия. 8 класс», иначе вопросу вырубки лесов во многих частях света уделялось бы более серьезное внимание. Это, кстати, касается и проблемы наличия угарного газа в окружающей среде. Количество отходов человеческой жизнедеятельности и процент выбросов этого необычайно токсичного материала в окружающую среду растет изо дня в день. И не факт, что не повторится судьба мира, описанная в прекрасном мультфильме «Волли», когда человечеству пришлось покинуть загаженную до основания Землю и отправиться в другие миры на поиски лучшей жизни.
Окись углерода — это… Что такое Окись углерода?
Монооксид углерода (лат. Carbon monoxide; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
Регистрационные номера:
- ICSC 0023
- RTECS FG3500000
- ООН 1016
- EC 006-001-00-2
Классификация ООН
- Класс опасности ООН 2,3
- Вторичная опасность по классификации ООН 2,1
Строение молекулы
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ2Oσ2zπ4x, yσ2C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
Молекула слабо поляризована, электрический момент её диполя μ = 0,04·10-29Кл·м (направление дипольного момента O—→C+). Ионизационный потенциал 14,0 в, силовая константа связи k = 18,6.
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Монооксид углерода в атмосфере Земли
Содержание CO в атмосфере Земли по данным MOPITT
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2C + O2 → 2CO↑ (тепловой эффект этой реакции 22 кДж),
2. или при восстановлении диоксида углерода раскалённым углём:
CO2 + C ↔ 2CO↑ (ΔH=172 кДж, ΔS=176 Дж/К).
Эта реакция часто происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ». Картина протекающих в печи реакций приведена на схеме.
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
HCOOH →(t, H2SO4) H2O + CO↑
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
HCOOH + ClSO3H → H2SO4 + HCl + CO↑.
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
H2C2O4 →(t, H2SO4) CO↑ + CO2↑ + H2O.
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
K4[Fe(CN)6] + 6H2SO4 →(t) 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO↑.
Токсическое действие CO на человека
Физиологическое действие, токсичность
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаками отравления служат головная боль, головокружение и потеря сознания. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее, чем кислород (при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки кислорода и клеточного дыхания. Предельно допустимая концентрация монооксида углерода в воздухе промышленных предприятий составляет 0,02 мг/л. Концентрация более 0,1 % — смертельна. В выхлопе бензинового автомобиля допускается до 1,5-3 %.
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
Свойства
Монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
H2O + CO ↔ CO2 + H2 + 42 кДж
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
CO + 1/2O2 → 2CO2 ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/K
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
CO + Cl2 → COCl2
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
(FCO)2O2 + 2KI → 2KF + I2 + 2CO2↑
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
CO + S → COS ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/K
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
Восстанавливает SO2:
SO2 + 2CO → 2CO2 + S
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
CO + KOH → HCOOK
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
2K + 2CO → K+O——C2—O—K+
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
CO + NH3 → H2O + HCN
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
PdCl2 + H2O + CO → CO2 + 2HCl + Pd↓
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
5CO + I2O5 → 5CO2 + I2
Применение
- Моноксид углерода применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса (en:Clear smoke или en:Tasteless smoke технология). Допустимая концентрация CO равна 200 мг/кг мяса.
См. также
Литература
- Ахметов Н. С. Общая и неорганическая химия. 5-е изд., испр. — М.: Высш. шк.; 2003 ISBN 5-06-003363-5
- Некрасов Б. В. Основы общей химии. Т. I, изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. Стр. 495—497, 511—513
- Химия: Справ. из./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Перс. с нем. 2-е изд., стереотип. — М.:Химия, 2000 ISBN 5-7245-0360-3 (рус.)
Ссылки
Wikimedia Foundation. 2010.
